
【题目】下列有关工业生产的叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸厂靠近原料产地比靠近硫酸消费中心更为有利
C.由于2SO2(g)+O2(g)![]() 2SO3(g),所以硫酸生产中常采用高压条件提高SO2的转化率
2SO3(g),所以硫酸生产中常采用高压条件提高SO2的转化率
D.充分利用硫酸厂生产过程中产生的“废热”,可使硫酸厂向外界输出大量的能量
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
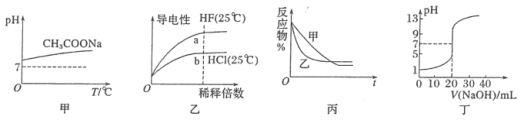
A.图甲表示升高温度醋酸钠的水解程度增大,溶液碱性增强
B.图乙表示氢氟酸为弱酸,且a点Kw的数值比b点Kw的数值大
C.图丙表示压强对可逆反应A(g)+B(g)![]() C(g)+D(s)的影响,乙的压强比甲的压强大
C(g)+D(s)的影响,乙的压强比甲的压强大
D.图丁表示0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1醋酸溶液的滴定曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某体积可变的密闭容器中加入一定量的A、B,发生反应mA(g) ![]() nB(g)ΔH==Q kJ·mol-1。反应达到平衡时,B的物质的量浓度与温度、容器容积的关系如表所示。下列说法正确的是
nB(g)ΔH==Q kJ·mol-1。反应达到平衡时,B的物质的量浓度与温度、容器容积的关系如表所示。下列说法正确的是

A.m>n
B.100℃时达平衡后,再向容器中充入一定量的A,再次达到平衡时,B物质的量浓度增大
C.温度不变,压强增大,B的质量分数减小
D.容器容积不变,温度升高,平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氢铝锂(LiAlH4)常作有机合成的重要还原剂。以辉锂矿(主要成分是Li2O·Al2O3·4SiO2,含少量Fe2O3)为原料合成四氢铝锂的流程如下:
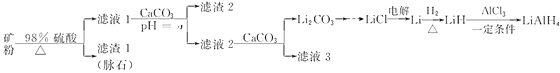
已知:①几种金属氢氧化物沉淀的pH如下表所示:
物质 | Fe(OH)3 | Al(OH)3 |
开始沉淀的pH | 2.3 | 4.0 |
完全沉淀的pH | 3.7 | 6.5 |
②常温下,Ksp(Li2CO3)=2.0×10-3,Li2CO3在水中溶解度随着温度升高而减小。
回答下列问题:
(1)上述流程中,提高“酸浸”速率的措施有______________________________________、______________________________________________________________________________(写两条);加入CaCO3的作用是__________________,“a”的最小值为___________。
(2)设计简单方案由Li2CO3制备LiCl:__________。
(3)写出LiH和AlCl3反应的化学方程式为______________________(条件不作要求)。
(4)用热水洗涤Li2CO3固体,而不用冷水洗涤,其目的是________________;检验碳酸锂是否洗净的实验方法是_____________________。
(5)在有机合成中,还原剂的还原能力通常用“有效氢”表示,其含义是1克还原剂相当于多少克氢气的还原能力。LiAlH4的“有效氢”为_________________(结果保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)已知H-O键能为463 kJ·mol-1,O=O键能为498 kJ·mol-1。若1 mol氢气完全燃烧生成1 mol气态水放出241 kJ的热量,计算H-H键能为______kJ·mol-1。
(2)已知化学方程式:H2(g)+![]() O2(g) ==H2O(g),该反应的活化能为167.2 kJ·mol-1,其逆反应的活化能为409.0 kJ·mol-1,写出该反应的逆反应的热化学方程式: ________。
O2(g) ==H2O(g),该反应的活化能为167.2 kJ·mol-1,其逆反应的活化能为409.0 kJ·mol-1,写出该反应的逆反应的热化学方程式: ________。
(3)4Al(s)+3O2(g)==2Al2O3(s)ΔH1,4Fe(s)+3O2(g)==2Fe2O3(s)ΔH2,则ΔH1________ΔH2(选填“﹥”、“﹤”或“﹦”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在科研与生活中有重要应用。某兴趣小组用0.50 mol·L-1KI溶液、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8溶液、0.10 mol·L-1Na2S2O3溶液等试剂,探究反应条件对化学反应速率的影响。已知:S2O82—+2I-=2SO42—+I2(慢),I2+2S2O32—=2I-+S4O62—(快)。请回答下列问题:
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的________耗尽后,溶液颜色将由无色变为蓝色。为确保能观察到蓝色,S2O32—与S2O82—初始的物质的量需满足的关系为:n(S2O32—)∶n(S2O82—)___。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验 序号 | 体积V/mL | ||||
K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx=___ mL,理由是__________。
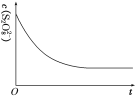
(3)已知某条件下,浓度c(S2O82—)~反应时间t的变化曲线如图, 若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82—)~t的变化曲线示意图(进行相应的标注) ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中物质的循环利用有多种模式。例如:
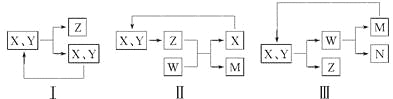
下列表述正确的是 ( )。
A.图Ⅰ可用于合成氨中N2、H2的循环
B.图Ⅰ可用于氨碱法制纯碱中CO2的循环
C.图Ⅱ可用于电解饱和食盐水中NaCl的循环
D.图Ⅲ可用于氨氧化法制硝酸中NO的循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中,A、C及B、D分别是同主族元素;A元素的原子半径是所有主族元素中原子半径最小的;B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的2倍;四种元素所形成的单质中A、B单质是气体,C、D单质是固体。
(1)写出以下元素的名称:B___;C___。
(2)写出D元素在周期表中的位置___。
(3)用电子式表示C2D的形成过程:___。
(4)写出由B、C两元素所形成的原子个数比为1:1的化合物的的电子式___;属于___(填“离子”或“共价”)化合物,存在的化学键的种类有___;写出它与水反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知烃A的分子式为C6H12,分子中含有碳碳双键,且仅有一种类型的氢原子,在下面的转化关系中,D1、D2互为同分异构体,E1、E2互为同分异构体。
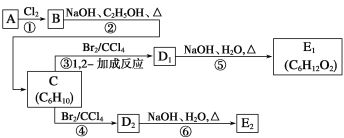
(1)反应②的化学方程式为
___________________________________________________________;
(2)C的化学名称是_____________________________;E2的结构简式是_______________________;
(3)④、⑥的反应类型依次是_________________________、__________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com