
【题目】请回答下列问题:
(1)已知H-O键能为463 kJ·mol-1,O=O键能为498 kJ·mol-1。若1 mol氢气完全燃烧生成1 mol气态水放出241 kJ的热量,计算H-H键能为______kJ·mol-1。
(2)已知化学方程式:H2(g)+![]() O2(g) ==H2O(g),该反应的活化能为167.2 kJ·mol-1,其逆反应的活化能为409.0 kJ·mol-1,写出该反应的逆反应的热化学方程式: ________。
O2(g) ==H2O(g),该反应的活化能为167.2 kJ·mol-1,其逆反应的活化能为409.0 kJ·mol-1,写出该反应的逆反应的热化学方程式: ________。
(3)4Al(s)+3O2(g)==2Al2O3(s)ΔH1,4Fe(s)+3O2(g)==2Fe2O3(s)ΔH2,则ΔH1________ΔH2(选填“﹥”、“﹤”或“﹦”)。
【答案】436 H2O(g) == H2(g)+1/2O2(g) ΔH=+241.8 kJ·mol-1 <
【解析】
(1)根据ΔH=反应物的总键能-生成物的总键能进行计算;
(2)根据逆反应的反应热=逆反应活化能-正反应活化能进行计算;
(3)根据铝热反应的反应热及盖斯定律进行比较;
(1)设H-H键能为x kJ·mol-1,则ΔH=反应物的总键能-生成物的总键能=x+![]() ×498 -2×463 =-241,解得x=436 kJ·mol-1;
×498 -2×463 =-241,解得x=436 kJ·mol-1;
(2)逆反应的反应热=逆反应活化能-正反应活化能=409 kJ·mol-1-167.2 kJ·mol-1=+241.8kJ·mol-1,逆反应的热化学方程式为:H2O(g) == H2(g)+1/2O2(g) ΔH=+241.8 kJ·mol-1;
(3)①4Al(s)+3O2(g)==2Al2O3(s) ΔH1,②4Fe(s)+3O2(g)==2Fe2O3(s) ΔH2,由盖斯定律可知,①-②可得4Al(s)+2Fe2O3(s)==2Al2O3(s)+4Fe(s) ΔH=ΔH1-ΔH2,铝热反应为放热反应,则ΔH=ΔH1-ΔH2<0,即ΔH1<ΔH2。


科目:高中化学 来源: 题型:
【题目】按要求回 答下列问题:
(1)键线式![]() 的系统命名为____________;
的系统命名为____________;
(2)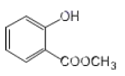 中含有官能团的名称为____________;
中含有官能团的名称为____________;
(3)2-甲基-1-丁烯的结构简式____________;
(4)相对分子质量为72且一氯代物只有一种的烷烃的结构简式____________;
(5) 的最简式为____________。
的最简式为____________。
(6)写出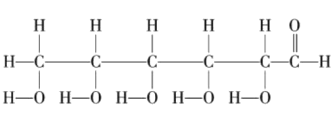 中所含官能团的电子式:____________、____________。
中所含官能团的电子式:____________、____________。
(7)分子式为C2H6O的有机物,有两种同分异构体,乙醇(CH3CH2OH)、甲醚(CH3OCH3),则通过下列方法,不可能将二者区别开来的是____________;
A.红外光谱 B.核磁共振氢谱 C.元素分析仪 D.与钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钠![]() 化合物中钠元素是
化合物中钠元素是![]() 价,NaH跟水反应放出
价,NaH跟水反应放出![]() ,下列叙述正确的是( )
,下列叙述正确的是( )
A.在NaH中的氢离子半径比锂离子半径大
B.在NaH中的氢离子的电子层排布与![]() 不相同
不相同
C.NaH跟水反应后溶液呈酸性
D.NaH中的氢离子被还原成氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法正确的是
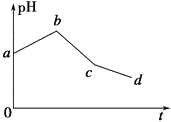
A.整个过程中两电极反应2Cl--2e-=Cl2↑、2H++2e-=H2↑不可能同时发生
B.电解至c点时,往电解液中加入适量CuCl2固体,即可使电解液恢复至原来的浓度
C.ab段表示电解过程中H+被还原,pH上升
D.原混合溶液中KCl和CuSO4的浓度之比恰好为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸是一种常见的有机酸,结构简式为![]() 苹果酸可能发生的反应是( )
苹果酸可能发生的反应是( )
①与NaOH溶液反应 ②与石蕊试液作用变红
③等量的苹果酸与足量的Na、NaHCO3在相同条件下生成的气体一样多
④一定条件下与乙酸酯化 ⑤一定条件下与乙醇酯化
A.①②③B.①②④⑤
C.①②③⑤D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关工业生产的叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸厂靠近原料产地比靠近硫酸消费中心更为有利
C.由于2SO2(g)+O2(g)![]() 2SO3(g),所以硫酸生产中常采用高压条件提高SO2的转化率
2SO3(g),所以硫酸生产中常采用高压条件提高SO2的转化率
D.充分利用硫酸厂生产过程中产生的“废热”,可使硫酸厂向外界输出大量的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】830 K时,在密闭容器中发生下列可逆反应: CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0 。请回答下列问题:
CO2(g)+H2(g) ΔH<0 。请回答下列问题:
(1)若起始时c(CO) =2 mol·L-1,c(H2O) =3 mol·L-1,4 s后达到平衡,此时CO的转化率为60%,则在该温度下,该反应的平衡常数K=____;用H2O表示的化学反应速率为_____。
(2)在相同温度下,若起始时c(CO) =1 mol·L-1,c(H2O) =2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,此时v(正)______ v(逆) (填“大于”“小于”或“等于”)。
(3)若降低温度,该反应的K值可能为______。
a.1 b.2 c.0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应3A(g)+2B(g) ![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是![]()
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,化学平衡常数增大
D. 增加B,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+3H2O
B.向NaAlO2溶液中加入NaHCO3溶液:HCO3-+AlO2-+H2O=CO2↑+Al(OH)3↓
C.铁电极电解饱和食盐水:Fe+2H2O![]() Fe(OH)2↓+H2↑
Fe(OH)2↓+H2↑
D.向Ca(ClO)2溶液中通入过量的CO2气体:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com