
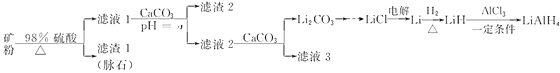
【题目】四氢铝锂(LiAlH4)常作有机合成的重要还原剂。以辉锂矿(主要成分是Li2O·Al2O3·4SiO2,含少量Fe2O3)为原料合成四氢铝锂的流程如下:
已知:①几种金属氢氧化物沉淀的pH如下表所示:
物质 | Fe(OH)3 | Al(OH)3 |
开始沉淀的pH | 2.3 | 4.0 |
完全沉淀的pH | 3.7 | 6.5 |
②常温下,Ksp(Li2CO3)=2.0×10-3,Li2CO3在水中溶解度随着温度升高而减小。
回答下列问题:
(1)上述流程中,提高“酸浸”速率的措施有______________________________________、______________________________________________________________________________(写两条);加入CaCO3的作用是__________________,“a”的最小值为___________。
(2)设计简单方案由Li2CO3制备LiCl:__________。
(3)写出LiH和AlCl3反应的化学方程式为______________________(条件不作要求)。
(4)用热水洗涤Li2CO3固体,而不用冷水洗涤,其目的是________________;检验碳酸锂是否洗净的实验方法是_____________________。
(5)在有机合成中,还原剂的还原能力通常用“有效氢”表示,其含义是1克还原剂相当于多少克氢气的还原能力。LiAlH4的“有效氢”为_________________(结果保留2位小数)。
【答案】粉碎矿石 加热 调节pH使Al3+、Fe3+转化成氢氧化物 6.5 用盐酸溶解,在氯化氢气流中蒸干溶液 AlCl3+4LiH===LiAlH4+3LiCl 减少碳酸锂的损失 取最后一次洗涤液于试管中,滴加氯化钡溶液和稀硝酸(或其他合理答案) 0.21
【解析】
辉锂矿(主要成分是Li2OAl2O34SiO2,含少量Fe2O3)为原料合成四氢铝锂,矿粉中加入浓硫酸然后过滤,得到的滤渣1为脉石,滤液1中含有硫酸铁、硫酸铝、硫酸锂和硫酸,向滤液1中加入碳酸钙,碳酸钙和氢离子反应从而调节溶液的pH,使溶液中铁离子、铝离子转化为沉淀,滤液2中含有硫酸锂和硫酸钙,向滤液2中加入碳酸钙,得到碳酸锂沉淀和滤液3,电解氯化锂得到Li,Li和氢气化合得到LiH,LiH和氯化铝在一定条件下反应生成LiAlH4,据此分析作答。
(1)加硫酸从矿石中浸出,如粉碎矿石、提高硫酸浓度、加热等措施可以提高反应速率。加入碳酸钙中和溶液中的酸,使铁、铝离子完全生成氢氧化铁、氢氧化铝沉淀。
(2)在氯化氢中蒸干氯化锂溶液,类似从海水中提取氯化镁。
(3)氯化铝与氢化锂反应生成四氢铝锂和氯化锂。
(4)依题意,碳酸锂的溶解度随温度升高而减小,用热水洗涤碳酸锂,可以减少碳酸锂损失。沉淀表面有硫酸钠,检验SO42-可判断沉淀是否洗净。
(5)由题给信息可知,还原剂的还原能力实指失电子数。
(1)加硫酸从矿石中浸出,如粉碎矿石、提高硫酸浓度、加热等措施可以提高反应速率。加入碳酸钙中和溶液中的酸,使铁、铝离子完全生成氢氧化铁、氢氧化铝沉淀。从表格信息看,调节pH最小值为6.5,确保铝离子完全沉淀。
(2)在氯化氢中蒸干氯化锂溶液,类似从海水中提取氯化镁。
(3)氯化铝与氢化锂反应生成四氢铝锂和氯化锂,方程式为AlCl3+4LiH===LiAlH4+3LiCl。
(4)依题意,碳酸锂的溶解度随温度升高而减小,用热水洗涤碳酸锂,可以减少碳酸锂损失。沉淀表面有硫酸钠,检验SO42-可判断沉淀是否洗净。检验碳酸锂是否洗净的实验方法:取最后一次洗涤液于试管中,滴加氯化钡溶液和稀硝酸(或其他合理答案)。
(5)由题给信息可知,还原剂的还原能力实指失电子数,1 mol LiAlH4能提供8 mol电子,相当于4 mol H2,LiAlH4的有效氢为8 g/38 g≈0.21。


科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑧种元素,请按要求填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在元素①②⑤⑥⑦⑧对应的最高价氧化物的水化物中,碱性最强的化合物的电子式是:_________;
(2)写出元素②的最简单氢化物的化学式____________;
(3)④⑤⑥⑦四种元素的简单离子半径从大到小排序____________(用离子符号表示);
(4)写出元素⑥的最高价氧化物与元素⑤的最高价氧化物的水化物反应的离子方程式______________________________________;
(5)写出元素③的常见氢化物和它的最高价氧化物的水化物反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:![]() 在恒容容器中进行,达到平衡状态的标志是( )
在恒容容器中进行,达到平衡状态的标志是( )
①单位时间内生成![]() 的同时生成
的同时生成![]()
②单位时间内生成![]() 的同时生成
的同时生成![]()
③用![]() 、
、![]() 、
、![]() 的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态
的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥B.②③⑤C.①③④D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选做[化学—选修3:物质结构与性质] (15分)X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
(1)R核外电子排布式为__________________。
(2)X、Y、Z、W形成的有机物YW(ZX2)2中Y、Z的杂化轨道类型分别为__________,ZW3-离子的立体构型是__________。
(3)Y、R的最高价氧化物的沸点较高的是_____________(填化学式),原因是_________________。
(4)将Q单质的粉末加入到ZX3的浓溶液中,并通入W2,充分反应后溶液呈深蓝色,该反应的离子方程式为______________________________________。
(5)W和Na的一种离子化合物的晶胞结构如图,该离子化合物为____________(填化学式)。Na+的配位数为_____________,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为__________。已知该晶胞的密度为ρg·cm-3,阿伏加德罗常数为NA,则两个最近的W离子间距离为 nm(用含ρ、NA的计算式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法正确的是
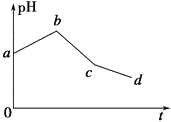
A.整个过程中两电极反应2Cl--2e-=Cl2↑、2H++2e-=H2↑不可能同时发生
B.电解至c点时,往电解液中加入适量CuCl2固体,即可使电解液恢复至原来的浓度
C.ab段表示电解过程中H+被还原,pH上升
D.原混合溶液中KCl和CuSO4的浓度之比恰好为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00 mL 0.100 mol·L-1 CH3COONa溶液中逐滴加入0.100 0 mol·L-1盐酸,溶液的pH与所加盐酸体积的关系如下图所示(不考虑挥发)。下列说法正确的是

A. 点①所示溶液中:c(CH3COOH)=c(Cl-)>c(OH-)=c(H+)
B. 点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C. 点③所示溶液中:c(CH3COOH)>c(Na+)>c(H+)>c(CH3COO-)
D. 整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关工业生产的叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸厂靠近原料产地比靠近硫酸消费中心更为有利
C.由于2SO2(g)+O2(g)![]() 2SO3(g),所以硫酸生产中常采用高压条件提高SO2的转化率
2SO3(g),所以硫酸生产中常采用高压条件提高SO2的转化率
D.充分利用硫酸厂生产过程中产生的“废热”,可使硫酸厂向外界输出大量的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NH3代替氢气研发燃料电池是当前科研的一个热点。使用的电解质溶液是2mol·L1的KOH溶液,电池总反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为____________________;每消耗3.4g NH3转移的电子数目为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雷美替胺是首个没有列为特殊管制的非成瘾失眠症治疗药物,合成该有机物过程中涉及如下转化,下列说法不正确的是( )
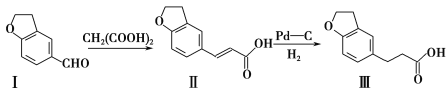
A.溴水无法区分化合物I和化合物Ⅱ
B.化合物Ⅰ、Ⅱ、Ⅲ均能与NaHCO3溶液发生反应
C.1 mol化合物Ⅲ最多能与3 mol H2发生加成反应
D.化合物Ⅰ、Ⅱ、Ⅲ分子中不存在手性碳原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com