
【题目】下表是元素周期表的一部分,针对表中的①~⑧种元素,请按要求填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在元素①②⑤⑥⑦⑧对应的最高价氧化物的水化物中,碱性最强的化合物的电子式是:_________;
(2)写出元素②的最简单氢化物的化学式____________;
(3)④⑤⑥⑦四种元素的简单离子半径从大到小排序____________(用离子符号表示);
(4)写出元素⑥的最高价氧化物与元素⑤的最高价氧化物的水化物反应的离子方程式______________________________________;
(5)写出元素③的常见氢化物和它的最高价氧化物的水化物反应的化学方程式_______________。
【答案】![]() CH4 r(S2-)> r(O2)-> r(Na+)> r(Al3+ ) (或S2 、O2-、 Na+ 、Al3+) Al2O3+2OH-==2AlO2- + H2O NH3+HNO3=NH4NO3
CH4 r(S2-)> r(O2)-> r(Na+)> r(Al3+ ) (或S2 、O2-、 Na+ 、Al3+) Al2O3+2OH-==2AlO2- + H2O NH3+HNO3=NH4NO3
【解析】
由元素在周期表中的位置,可推断出:①为Li②为C③为N④为O⑤为Na⑥为Al⑦为S⑧为Cl,再根据元素的性质及元素周期表中元素性质变化的规律进行解答。
(1)Na的金属性最强,所以NaOH的碱性最强,由钠离子和氢氧根离子构成,电子式为:![]() ;
;
答案为:![]() ;
;
(2)元素②是C,C的最简单氢化物是CH4;
答案为:CH4;
(3)④⑤⑥⑦四种元素是:O、Na、Al、S,它们的离子为:O2-、Na+、Al3+、S2-,离子电子层数越多半径越大,电子层数相同的离子核电荷数越大半径越小,所以这四种离子半径由大到小的顺序为:r(S2-)> r(O2)-> r(Na+)> r(Al3+ ) (或S2 O2- Na+ Al3+)。
答案为:r(S2-)> r(O2)-> r(Na+)> r(Al3+ ) (或S2 、O2- 、Na+ 、Al3+)。
(4)元素⑥的最高价氧化物为Al2O3,元素⑤的最高价氧化物的水化物为NaOH,二者反应生成偏铝酸钠和水,离子方程式为:Al2O3+2OH-==2AlO2- + H2O;
答案为:Al2O3+2OH-==2AlO2- + H2O;
(5)元素③的常见氢化物为NH3,它的最高价氧化物的水化物为HNO3,二者反应生成NH4NO3,方程式为:NH3+HNO3=NH4NO3;
答案为:NH3+HNO3=NH4NO3;


 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中各微粒浓度关系不正确的是( )
A.pH相等的①CH3COONa②C6H5ONa③NaHCO3溶液中,c(Na+)大小关系:①>③>②
B.向氨水中滴加稀硫酸至溶液呈中性:c(NH4+)>c(SO42-)>c(OH-)=c(H+)
C.向1L 0.1mol/L的NaOH溶液中通入6.6gCO2:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.CH3COONa溶液中加入少量KNO3后的碱性溶液一定有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质从左至右按同类有机物、同位素、同系物、同分异构体、同素异形体、同种物质的顺序排列的是( )
①C60、C70、金刚石、石墨 ②苯甲醇、对甲基苯酚、邻甲基苯酚、间甲基苯酚
③![]() 、
、![]() 、
、![]() ④HOCH2CHO、HOCH2CH2CHO、HOCH2CH2CH2CHO
④HOCH2CHO、HOCH2CH2CHO、HOCH2CH2CH2CHO
⑤新戊烷、2,2二甲基丙烷 ⑥甲醇、乙二醇、丙三醇
A.①⑥②③⑤④B.⑥③⑤④①②
C.④②⑥①⑤③D.⑥③④②①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学实验的叙述正确的是( )
A.配制1molL-1的硫酸铜溶液200mL,需要称取胆矾晶体40g
B.蒸馏实验中,冷凝管中冷却水应从下口通入,从上口放出
C.欲除去Fe粉中混有的I2,可加热使I2升华
D.检验溶液中是否含有Fe2+的方法是:向溶液中滴加KSCN溶液无明显现象,再向溶液中加入适量双氧水发现有血红色沉淀生成,则说明原溶液中存在Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验是科学探究过程中的一种重要方法,掌握化学实验的基本操作和物质的制备、转化及性质的探究尤为重要,请结合所学化学实验知识回答以下问题。
I.实验室配制220mL 1 mol·L-1的稀H2SO4溶液:
(1)用量筒量取浓H2SO4(密度为1.84g·mL-1,质量分数为98%)的体积为________mL。
(2)误差下列情况使配制结果偏大的是________。
①溶解后未冷却即转移、定容
②定容时仰视容量瓶刻度线
③用量筒量取一定体积的浓硫酸时俯视
④将量筒、烧杯、玻璃棒洗涤2~3次,转移至容量瓶
II.某研究性学习小组在查阅资料时发现:化工厂常用氨气来检验氯气是否泄漏。于是他们设计实验探究氯气与氨气之间的反应。制备气体的实验装置有(可重复选用):
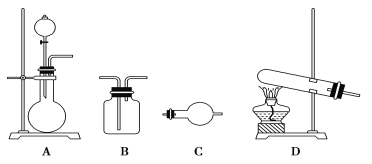
实验药品有:a.MnO2(s) b.浓盐酸 c.NH4Cl(S) d.KClO3(s) e.碱石灰 f.浓硫酸 g.饱和食盐水 h.NaOH(s) i.消石灰
请回答下列问题。
(1)利用上述实验装置与药品制备干燥氨气,应选用的装置有________(填字母序号)。发生反应的化学方程式为_________________________________。
(2)制取干燥氯气的装置由A、B、B组装而成,则B中应装的试剂依次是________(填字母序号) 。
(3)为使氯气、氨气在如图所示装置中充分混合并反应,在a口通入的气体是_______,若氨气量较多,则瓶内会出现大量白烟,该白烟为___________。
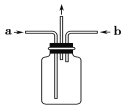
(4)已知,在水溶液中能发生反应3Cl2+2NH3===N2+6HCl,若氯气过量,氯气与氨气反应生成两种化合物,其中一种化合物分子的空间构型与NH3相似,则该反应的化学方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】那可汀是—种药物,该药适用于剌激性干咳病人服用,无成瘾性。化合物I是制备该药物的重要中间体,合成路线如下:
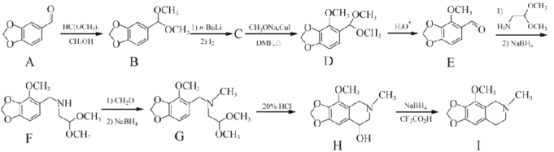
(1)化合物A中的官能团名称为____________(写两种)。
(2)I的分子式为____________。
(3)设计反应A-B的目的为____________。
(4)化合物C的分子式为C10H11O4I,写出C的结构简式:____________。
(5)化合物I的—种同分异构体同时满足下列条件,写出该同分异构体的结构简式:____________。
①分子中含有硝基(—NO2)且直接连在苯环上;②分子中只有3种不同化学环境的氢。
(6)写出以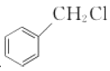 和
和 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
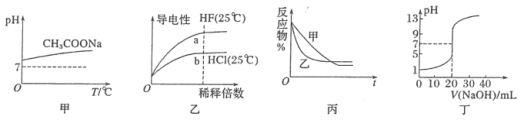
A.图甲表示升高温度醋酸钠的水解程度增大,溶液碱性增强
B.图乙表示氢氟酸为弱酸,且a点Kw的数值比b点Kw的数值大
C.图丙表示压强对可逆反应A(g)+B(g)![]() C(g)+D(s)的影响,乙的压强比甲的压强大
C(g)+D(s)的影响,乙的压强比甲的压强大
D.图丁表示0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1醋酸溶液的滴定曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Fe、Fe2O3和CuO的混合粉末加入到100mL 4.4mol/L 的盐酸中,充分反应后,充分反应后,生成标准状况下的氢气896mL。过滤,滤渣经洗涤、干燥后称量,质量为1.28g。滤液中的溶质只有FeCl2和HCl,滤液加水稀释到320mL时,盐酸的浓度为0.25mol/L。
请回答:
(1)反应生成氢气的物质的量为_______ mol;
(2)计算原混合物中铁单质的质量(写出计算过程)。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氢铝锂(LiAlH4)常作有机合成的重要还原剂。以辉锂矿(主要成分是Li2O·Al2O3·4SiO2,含少量Fe2O3)为原料合成四氢铝锂的流程如下:
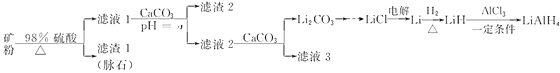
已知:①几种金属氢氧化物沉淀的pH如下表所示:
物质 | Fe(OH)3 | Al(OH)3 |
开始沉淀的pH | 2.3 | 4.0 |
完全沉淀的pH | 3.7 | 6.5 |
②常温下,Ksp(Li2CO3)=2.0×10-3,Li2CO3在水中溶解度随着温度升高而减小。
回答下列问题:
(1)上述流程中,提高“酸浸”速率的措施有______________________________________、______________________________________________________________________________(写两条);加入CaCO3的作用是__________________,“a”的最小值为___________。
(2)设计简单方案由Li2CO3制备LiCl:__________。
(3)写出LiH和AlCl3反应的化学方程式为______________________(条件不作要求)。
(4)用热水洗涤Li2CO3固体,而不用冷水洗涤,其目的是________________;检验碳酸锂是否洗净的实验方法是_____________________。
(5)在有机合成中,还原剂的还原能力通常用“有效氢”表示,其含义是1克还原剂相当于多少克氢气的还原能力。LiAlH4的“有效氢”为_________________(结果保留2位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com