
【题目】根据原子结构及元素周期律的知识,下列推断正确的是
A. 同主族元素含氧酸的酸性随核电荷数的增加而减弱
B. 核外电子排布相同的微粒化学性质也相同
C. Cl-、S2-、Ca2+、K+半径逐渐减小
D. ![]() 与
与![]() 得电子能力相同
得电子能力相同
科目:高中化学 来源: 题型:
【题目】(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H﹤0
CH4(g)+2H2O(g) △H﹤0
则升高温度平衡体系中H2的体积分数将___________;(选填“增大”、“减小”或“不变”)
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/mol·L-1 | [H2]/mol·L-1 | [CH4]/mol·L-1 | [H2O]/mol·L-1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为_________。
(3)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3-![]() H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。____________________
H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。____________________
(4)查阅资料获知如下信息:
i.H2CO3:Ki1=4.3×10-7,Ki2=5.6×10-11(以Ki1为主)
ii.标况下,CO2的溶解度为约为1:1
iii.H2O+CO2 ![]() H2CO3
H2CO3 ![]()
iv. ![]()
![]()
![]() ㏒(6)=0.8
㏒(6)=0.8
请尝试估算:
①饱和二氧化碳溶液中碳酸的物质的量浓度c(H2CO3)约为_______________mol/L;
②饱和二氧化碳溶液中碳酸的电离度α约为_____________。
③正常雨水的pH约为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法正确的是( )
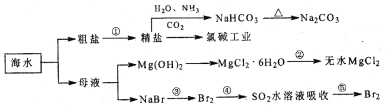
A.过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:
Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.在过程③、④、⑤中,溴元素均被氧化
C.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2
D.工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:
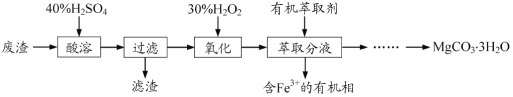
(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol–1
Mg2SiO4(s)+4H+(aq)===2 Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol–1
酸溶需加热的目的是______;所加H2SO4不宜过量太多的原因是_______。
(2)加入H2O2氧化时发生发应的离子方程式为___________。
(3)用如图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。
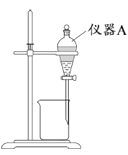
①实验装置图中仪器A的名称为_______。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,______、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,______,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效核能原料,其原子核内中子数为__________。
(2)Na的原子结构示意图为_________,Na在氧气中完全燃烧所得产物的电子式为________。
(3)MgCl2在工业上应用广泛,可由MgO制备。
①MgO的熔点比BaO的熔点________(填“高”或“低”)。
②月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为:_________。
③MgO与炭粉和氯气在一定条件下反应可制备MgCl2。若尾气可用足量NaOH溶液完全吸收, 则生成的盐为__________(写化学式)。
(4)月壤中含有丰富的3He,月壤中提炼1kg3He,同时可得6000kgH2和700 kg N2,若以所得H2和N2为原料经一系列反应最多可生产破酸氢铵________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计氨催化氧化实验,并将制得NO进一步氧化为NO2,用水吸收NO2,并检验HNO3的生成。
可供选择的固体药品有:NH4Cl、Ca(OH)2、KClO3、MnO2、CaO
可供选择的液体药品有:浓氨水、过氧化氢、浓盐酸、水
可供选择的仪器有:


另有铁架台、铁夹、铁圈、乳胶管若干,可供选择。设计实验时,每套装置最多只能使用一次。
(1)氨氧化制NO的化学反应方程式为________________。
(2)快速制取O2的装置最好选择_______;制取NH3的化学反应方程式为___________。
(3)各仪器按气流方向连接的正确顺序为:(按装置先后排列顺序补充完整)___________。

(4)装置C的作用是______________。
(5)装置H中溶液变红,其原因是(用总方程式表示)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组混合液:(1)甲酸乙酯和乙酸钠;(2)乙醇和丁醇;(3)溴化钠和单质
溴的水溶液,分离以上各混合液的正确方法依此是( )
A. 分液、萃取、蒸馏 B. 萃取、分液、蒸馏
C. 萃取、蒸馏、分液 D. 分液、蒸馏、萃取
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com