
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法正确的是( )
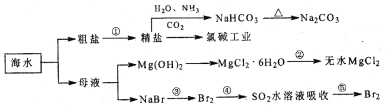
A.过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:
Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.在过程③、④、⑤中,溴元素均被氧化
C.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2
D.工业上通过电解饱和MgCl2溶液制取金属镁
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】按要求填写下列问题:
(1)某些共价化合物(如H2O、NH3、N2O4等)在液态时会发生微弱的电离,如:2H2O ![]() H3O+ + OH—,则液态NH3电离的方程式是________________
H3O+ + OH—,则液态NH3电离的方程式是________________
(2)某温度(t℃)时,测得0.01mol/L的NaOH溶液的pH=12,则该温度下水的KW= ,在此温度下,将pH=b的NaOH溶液Vb L与pH=a的H2SO4溶液Va L混合,若所得混合液为中性,且a+b=13,则Va:Vb=_________
(3)若在0.10 molL-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是 ,在0.10 molL-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=___________(已知Ksp[Cu(OH) 2]=2.2x10-20)。
(4)在常温下,中和相同体积,相同pH的Ba(OH)2、NH3H2O、NaOH三种稀溶液所用相同浓度的盐酸的体积分别为V1、V2、V3,则三种关系为 (用“V1、V2、V3”和“>、<、=”表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,如果取0.1molL-1HA溶液与0.1molL-1NaOH溶液等体积混合,测得混合液的pH=8。混合液中由水电离出的OH-浓度与0.1molL-1NaOH溶液中由水电离出的OH-浓度之比为__________.
(2)相同温度下,将足量硫酸钡固体分别放入相同体积的
①0.1molL-1硫酸铝溶液
②0.1molL-1氯化钡溶液
③蒸馏水
④0.1molL-1硫酸溶液中,
Ba2+浓度由大到小的顺序是 。(用序号填写)
(3)常温下,将a molL-1的氨水与0.1molL-1的盐酸等体积混合,当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3H2O的电离常数Kb= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学反应与能量的说法正确的是 ( )
A. 反应物总能量与生成物总能量一定相等 B. 中和反应是吸热反应
C. 形成化学键时吸收能量 D. 燃烧属于放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )
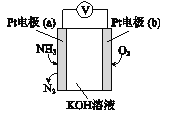
A. 溶液中OH-向电极a移动
B. 反应消耗的NH3与O2的物质的量之比为4:3
C. 负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O
D. 电子迁移方向:电极a→导线→电极b→电解质溶液→电极a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、煤制天然气的工艺流程简图如下:

⑴反应I:C(s) + H2O(g)![]() CO(g) + H2(g) ΔH = +135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:___________________________。
CO(g) + H2(g) ΔH = +135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:___________________________。
⑵反应II:CO(g) + H2O(g) ![]() CO2(g) + H2(g) ΔH = 41 kJ·mol-1。如图表示不同温度条件下,煤气化反应I发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
CO2(g) + H2(g) ΔH = 41 kJ·mol-1。如图表示不同温度条件下,煤气化反应I发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。

① 判断T1、T2和T3的大小关系:______________。(从小到大的顺序)
② 若煤气化反应I发生后的汽气比为0.8,经煤气化反应I和水气变换反应II后,得到CO与H2的物质的量之比为1:3,则反应II应选择的温度是_______(填“T1”或“T2”或“T3”)。
⑶① 甲烷化反应IV发生之前需要进行脱酸反应III。煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和_______。
② 工业上常用热碳酸钾溶液脱除H2S气体得到两种酸式盐,该反应的离子方程式是_______。
II、利用甲烷超干重整CO2技术可得到富含CO的气体,将甲烷和二氧化碳转化为可利用的化学品,其能源和环境上的双重意义重大。该技术中的化学反应为:
CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g)
2H2O(g)+4CO(g) ![]() H>0
H>0
CH4超干重整CO2的催化转化原理示意如图:

⑷过程II,实现了含氢物种与含碳物种的分离。生成H2O(g)的化学方程式是______________。
⑸假设过程I和过程II中的各步均转化完全,下列说法正确的是_______。((填序号)
a.过程I和过程II中均含有氧化还原反应
b.过程II中使用的催化剂为Fe3O4 和CaCO3
c.若过程I投料![]() ,可导致过程II中催化剂失效
,可导致过程II中催化剂失效
(6)一定条件下,向体积为2L的恒容密闭容器中充入1.2 mol CH4(g)和4.8 mol CO2(g),发生反应CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g)
2H2O(g)+4CO(g) ![]() H>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,此反应的
H>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,此反应的![]() H=________________。
H=________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原子结构及元素周期律的知识,下列推断正确的是
A. 同主族元素含氧酸的酸性随核电荷数的增加而减弱
B. 核外电子排布相同的微粒化学性质也相同
C. Cl-、S2-、Ca2+、K+半径逐渐减小
D. ![]() 与
与![]() 得电子能力相同
得电子能力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是( )
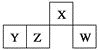
A. 原子半径:r(W)>r(Z)>r( Y)>r(X)
B. Y元素的单质只能跟酸反应
C. 最简单气态氢化物的热稳定性:W>Z
D. W元素氧化物对应的水化物均为强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com