
【题目】I、煤制天然气的工艺流程简图如下:

⑴反应I:C(s) + H2O(g)![]() CO(g) + H2(g) ΔH = +135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:___________________________。
CO(g) + H2(g) ΔH = +135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:___________________________。
⑵反应II:CO(g) + H2O(g) ![]() CO2(g) + H2(g) ΔH = 41 kJ·mol-1。如图表示不同温度条件下,煤气化反应I发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
CO2(g) + H2(g) ΔH = 41 kJ·mol-1。如图表示不同温度条件下,煤气化反应I发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。

① 判断T1、T2和T3的大小关系:______________。(从小到大的顺序)
② 若煤气化反应I发生后的汽气比为0.8,经煤气化反应I和水气变换反应II后,得到CO与H2的物质的量之比为1:3,则反应II应选择的温度是_______(填“T1”或“T2”或“T3”)。
⑶① 甲烷化反应IV发生之前需要进行脱酸反应III。煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和_______。
② 工业上常用热碳酸钾溶液脱除H2S气体得到两种酸式盐,该反应的离子方程式是_______。
II、利用甲烷超干重整CO2技术可得到富含CO的气体,将甲烷和二氧化碳转化为可利用的化学品,其能源和环境上的双重意义重大。该技术中的化学反应为:
CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g)
2H2O(g)+4CO(g) ![]() H>0
H>0
CH4超干重整CO2的催化转化原理示意如图:

⑷过程II,实现了含氢物种与含碳物种的分离。生成H2O(g)的化学方程式是______________。
⑸假设过程I和过程II中的各步均转化完全,下列说法正确的是_______。((填序号)
a.过程I和过程II中均含有氧化还原反应
b.过程II中使用的催化剂为Fe3O4 和CaCO3
c.若过程I投料![]() ,可导致过程II中催化剂失效
,可导致过程II中催化剂失效
(6)一定条件下,向体积为2L的恒容密闭容器中充入1.2 mol CH4(g)和4.8 mol CO2(g),发生反应CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g)
2H2O(g)+4CO(g) ![]() H>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,此反应的
H>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,此反应的![]() H=________________。
H=________________。

【答案】 氧气与碳发生燃烧反应放热,放出的热被可逆反应吸收利用,促进反应正向移动 T1 < T2 < T3 T3 CO2 CO32- + H2S ![]() HS - + HCO3- 4H2+Fe3O4
HS - + HCO3- 4H2+Fe3O4 ![]() 3Fe+4H2O a c +330 kJ/mol
3Fe+4H2O a c +330 kJ/mol
【解析】I、(1)C(s)+H2O(g)![]() CO(g)+H2(g)△H=+135kJmol-1,是吸热反应,而碳与氧气反应放出热量,使反应C(s)+H2O(g)
CO(g)+H2(g)△H=+135kJmol-1,是吸热反应,而碳与氧气反应放出热量,使反应C(s)+H2O(g)![]() CO(g)+H2(g),向正反应方向移动,提高碳的利用率;
CO(g)+H2(g),向正反应方向移动,提高碳的利用率;
(2)①反应CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=-41kJmol-1的正反应为放热反应,温度越高一氧化碳的转化率越低,由图可知,温度的大小为:T1<T2<T3;
CO2(g)+H2(g)△H=-41kJmol-1的正反应为放热反应,温度越高一氧化碳的转化率越低,由图可知,温度的大小为:T1<T2<T3;
②若煤气化反应I发生后的汽气比为0.8,设水蒸气的物质的量是4mol、则生成的CO物质的量为5mol,同时生成5mol氢气,经煤气化反应I和水气变换反应II后,设反应II中CO转化的为xmol,则生成xmol氢气,则(5-x):(5+x)=1:3,x=2.5,CO的转化率=![]() ×100%=50%,根据图知,反应温度为T3;
×100%=50%,根据图知,反应温度为T3;
(3)①根据方程式II知,生成的酸性气体还有二氧化碳;
②工业上常用热碳酸钾法脱除H2S气体得到两种酸式盐,则二者反应生成碳酸氢钾和硫氢化钾,反应方程式为K2CO3+H2S═KHS+KHCO3;
II、⑷由图示可知,过程II中氢气还原Fe3O4生成H2O,发生反应的化学方程式是4H2+Fe3O4 ![]() 3Fe+4H2O;
3Fe+4H2O;
⑸假设过程I和过程II中的各步均转化完全,下列说法正确的是_______。((填序号)
a.过程I有氢气生成,而过程II中存在氢气还原四氧化三铁和CO还原四氧化三铁,均属于氧化还原反应,故a正确;b.过程II中使用的催化剂为Fe3O4和CaO,故b错误;c.若过程I投料![]() ,则CH4和CO2恰好生成CO和H2,无多余的CO2,导致过程II中只能生成FeO,催化剂效果降低,故c正确;答案为ac;
,则CH4和CO2恰好生成CO和H2,无多余的CO2,导致过程II中只能生成FeO,催化剂效果降低,故c正确;答案为ac;
(6) CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g)
2H2O(g)+4CO(g)
起始物质的量(mol) 1.2 4.8 0 0
变化物质的量(mol) x 3x 2x 4x
平衡物质的量(mol) 1.2- x 4.8-3x 2x 4x
平衡时CH4的体积为![]() =
=![]() ,解得x=0.36mol,则
,解得x=0.36mol,则![]() H=+118.8×
H=+118.8×![]() kJ/mol=+330kJ/mol。
kJ/mol=+330kJ/mol。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】TPE及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛。TPE的结构简式如图,下列关于TPE的说法正确的是

A. TPE属于苯的同系物
B. TPE能发生加成反应,但不能取代反应
C. TPE与化合物 互为同分异构体
互为同分异构体
D. TPE的一氯代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaCl固体配制一定物质的量浓度的溶液时,操作要领包括:①溶解;②定容;③转移;④计算;⑤称量⑥洗涤⑦摇匀等方面,其正确的操作顺序是( )
A. ①②⑥③④⑤⑦ B. ④①②⑥③⑤⑦
C. ④⑤①③⑥②⑦ D. ④⑤③⑥②①⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法正确的是( )
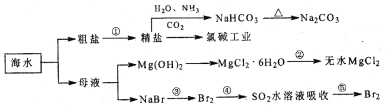
A.过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:
Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.在过程③、④、⑤中,溴元素均被氧化
C.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2
D.工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)烷烃A在同温、同压下蒸气的密度是H2的43倍,其分子式为___________。
(2)0.1 mol 烷烃E完全燃烧,消耗标准状况下的O211.2 L,其分子式为___________。
(3)用式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为____________。
(4)某有机物的结构表达式为![]() ,其名称是_______________。
,其名称是_______________。
(5)萘的结构式为![]() ,其分子式为 ,它的二氯代物又有 种。
,其分子式为 ,它的二氯代物又有 种。
(6)立方烷![]() 其分子式为 ,它的六氯代物有 种。
其分子式为 ,它的六氯代物有 种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:
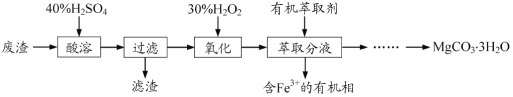
(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol–1
Mg2SiO4(s)+4H+(aq)===2 Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol–1
酸溶需加热的目的是______;所加H2SO4不宜过量太多的原因是_______。
(2)加入H2O2氧化时发生发应的离子方程式为___________。
(3)用如图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。
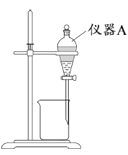
①实验装置图中仪器A的名称为_______。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,______、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,______,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效核能原料,其原子核内中子数为__________。
(2)Na的原子结构示意图为_________,Na在氧气中完全燃烧所得产物的电子式为________。
(3)MgCl2在工业上应用广泛,可由MgO制备。
①MgO的熔点比BaO的熔点________(填“高”或“低”)。
②月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为:_________。
③MgO与炭粉和氯气在一定条件下反应可制备MgCl2。若尾气可用足量NaOH溶液完全吸收, 则生成的盐为__________(写化学式)。
(4)月壤中含有丰富的3He,月壤中提炼1kg3He,同时可得6000kgH2和700 kg N2,若以所得H2和N2为原料经一系列反应最多可生产破酸氢铵________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如图所示。该电池工作时,下列说法正确的是( )

A.Mg电极是该电池的正极
B.H2O2在石墨电极上发生氧化反应
C.石墨电极附近溶液的pH增大
D.溶液中Cl-向正极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com