
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与![]() 的变化关系
的变化关系
C. 当混合溶液呈中性时,![]()
D. NaHX溶液中![]()
【答案】C
【解析】A、己二酸是二元弱酸,第二步电离小于第一步,即Ka1=![]() >Ka2=
>Ka2=![]() ,所以当pH相等即氢离子浓度相等时
,所以当pH相等即氢离子浓度相等时![]() >
>![]() ,因此曲线N表示pH与
,因此曲线N表示pH与![]() 的变化关系,则曲线M是己二酸的第二步电离,根据图像取-0.6和4.8点,
的变化关系,则曲线M是己二酸的第二步电离,根据图像取-0.6和4.8点,![]() =10-0.6mol·L-1,c(H+)=10-4.8mol·L-1,代入Ka2得到Ka2=10-5.4,因此Ka2(H2X)的数量级为10-6,故A正确;pH相等即氢离子浓度相等时
=10-0.6mol·L-1,c(H+)=10-4.8mol·L-1,代入Ka2得到Ka2=10-5.4,因此Ka2(H2X)的数量级为10-6,故A正确;pH相等即氢离子浓度相等时![]() >
>![]() ,因此曲线N表示pH与
,因此曲线N表示pH与![]() ,故B正确;根据图像,
,故B正确;根据图像,![]() =0时,即
=0时,即![]() 时溶液呈酸性,所以溶液呈中性时,
时溶液呈酸性,所以溶液呈中性时,![]() ,故C错误;曲线N是己二酸的第一步电离,根据图像去0.6和5.0,
,故C错误;曲线N是己二酸的第一步电离,根据图像去0.6和5.0,![]() ,
,![]() =
=![]() ,滴入Ka1(H2X)=
,滴入Ka1(H2X)=![]() ,
,![]() 的水解常数=
的水解常数=![]() <10-5.4,NaHX溶液呈酸性,
<10-5.4,NaHX溶液呈酸性,![]() ,故D正确。
,故D正确。


科目:高中化学 来源: 题型:
【题目】按要求填空。下面列出了几组物质,请将物质的合适组号填写在空格上。
A.金刚石与石墨;B.氕与氘;C.甲烷与戊烷;D.![]() 与
与 ;E.
;E.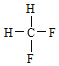 与
与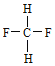 。
。
(1)同素异形体___;(2)同系物___;(3)同分异构体___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:
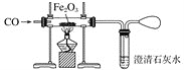
(1)写出得到单质铁的化学方程式:_________________________。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁:______。
(3)装置末端气球的作用为_____________________________。实验结束时,应该先停止加热还是先停止通入CO?原因是什么?_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用如下装置制备乙酸乙酯。下列有关分析不正确的是

A. b中导管不能插入液面下,否则会阻碍产物的导出
B. 固体酒精是一种白色凝胶状纯净物,常用于餐馆或野外就餐
C. 乙酸乙酯与![]() 互为同分异构体
互为同分异构体
D. 乙酸、水、乙醇羟基氢的活泼性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,书写错误的是( )
A.碳酸钠溶液跟稀硫酸混合: CO32﹣+2H+=H2O+CO2↑
B.硝酸铜溶液中滴加烧碱溶液: Cu2++2OH-=Cu(OH)2↓
C.将CO2通入足量的氢氧化钠溶液中: 2OH-+CO2=CO32﹣+H2O
D.硫酸溶液中加入Ba(OH)2溶液: Ba2++ SO![]() -=BaSO4↓
-=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298 K时,合成氨反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)
2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)
A. 一定小于92.0 kJ B. 一定大于92.0 kJ
C. 一定等于92.0 kJ D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】感冒是一种常见的病,病人患了感冒会咳嗽、流涕、发烧,多喝开水多休息,适当服用一些治疗感冒的药,可以舒缓症状,减轻病情。药物阿司匹林是一种传统的治疗感冒发烧的药,从分子结构上看,它可以看做是乙酸酯,其结构简式为
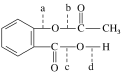
(1)阿司匹林与NaOH溶液反应中,可以断裂的化学键是________(填代号)。
(2)根据阿司匹林的结构推断它能够发生的化学反应类型为________(填序号)。
①中和反应 ②加成反应 ③取代反应
(3)阿司匹林连接在某高分子聚合物上,可形成缓解长效药物,其中的一种结构为
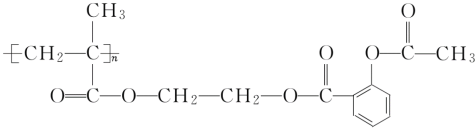
则缓释长效阿司匹林载体的结构简式为_______。
(4)长期大量服用阿司匹林会出现不良反应,一旦出现水杨酸中毒现象,应立即停药,并静脉滴注NaHCO3溶液,以解除水杨酸的中毒症状,反应的化学方程式为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的短周期主族元素。X分别与Y、Z、W结合形成质子数相同的甲、乙、丙三种分子。丁为无色气体,遇空气变红棕色;丙的水溶液可刻蚀玻璃。
上述物质有如图转化关系:

下列说法错误的是
A. 四种元素形成的单质中W的氧化性最强
B. 甲、乙、丙中沸点最高的是丙
C. 甲常用作致冷剂
D. 甲、乙分子均只含极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究AgCl的溶解平衡:向10 mL 1mol/L KCl 溶液中加入1 mL 0.2 mol/LAgNO3溶液,将浑浊液均分为2份,进行如下实验:
实验序号 | 实验操作 | 实验现象 |
I | 将其中一份浑浊液过滤,向滤液中放入Mg条
| i. 滤液澄清透明,用激光照射有丁达尔现象。 ii. 放入Mg条后,立即有无色气泡产生,气体可燃,滤液中出现白色浑浊。 iii. 一段时间后开始出现棕褐色浑浊物,Mg条表面也逐渐变为棕褐色,产生气泡的速率变缓慢。 |
II | 向另一份浑浊液中放入大小相同的Mg条
| iv. 棕褐色浑浊物的量明显多于实验I,Mg条表面棕褐色更深,其他现象与ii、iii相同。 |
已知:AgOH不稳定,立即分解为Ag2O(棕褐色或棕黑色),Ag粉为黑色,AgCl、Ag2O可溶于浓氨水生成Ag(NH3)2+
(1)滤液所属分散系为________。
(2)现象ii中无色气泡产生的原因是_________(写出化学方程式)。
(3)现象iii中,导致产生气泡的速率下降的主要影响因素是________。
(4)甲认为Mg条表面的棕褐色物质中一定有Ag和Ag2O,其中生成Ag的离子方程式为____。
(5)甲设计实验检验Ag:取实验I中表面变为棕褐色的Mg条于试管中,向其中加入足量试剂a,反应结束后,继续向其中加入浓硝酸,产生棕色气体,溶液中有白色不溶物。
① 白色不溶物为_____(填化学式),棕色气体产生的原因是_____(写离子方程式)。
② 试剂a为________,加入试剂a的目的是________。
③ 该实验能证明棕褐色物质中一定有Ag的实验现象是________。
(6)甲进一步设计实验验证了Mg条表面的棕褐色物质中有Ag2O,实验方案是:取实验I中表面变为棕褐色的Mg条_________。
(7)综合上述实验,能说明存在AgCl(s) ![]() Ag+(aq) + Cl-(aq)的证据及理由有________。
Ag+(aq) + Cl-(aq)的证据及理由有________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com