
【题目】下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体,化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应。

请回答下列问题:
(1)写出下列物质化学式:A_______C________D________
(2)写出下列物质间反应的化学方程式:
①A+B____________________;②F+CO2________________
③D+E___________________________;④I+J___________________
(3)写出下列反应的离子方程式G+I________________
【答案】Na Cl2 H2 2Na+O2![]() Na2O2 2Na2O2+2CO2=2NaCO3+O2 3H2+N2
Na2O2 2Na2O2+2CO2=2NaCO3+O2 3H2+N2![]() 2NH3 HCl+NH3=NH4Cl CO32-+2H+=H2O+CO2↑
2NH3 HCl+NH3=NH4Cl CO32-+2H+=H2O+CO2↑
【解析】
反应①是化工生产中的一种重要固氮反应,证明是N2和H2合成NH3的反应,判断J为NH3,化合物I和J通常状况下呈气态,C、D是非金属单质,依据反应条件是光照,推断为H2和Cl2生成HCl的反应,判断D为H2,E为N2,C为Cl2,I为HCl,J为NH3;化合物G的焰色反应为黄色说明含钠元素,G与HCl反应生成CO2,说明G为Na2CO3,气体单质B和A反应生成的F可以与CO2反应生成碳酸钠和气体B单质,说明F中含有钠元素,证明A为金属钠,推断B为O2,F为Na2O2,综合分析得到各物质符合转化关系,依据判断出的物质进行分析回答问题。
通过上述分析可知A为Na,B为O2,C为Cl2,D为H2,E为N2,F为Na2O2,G为Na2CO3,I为HCl,J为NH3。
(1)综上所述可知A是Na;C是Cl2;D是H2;
(2)①A和B发反应的化学方程式为2Na+O2![]() Na2O2;
Na2O2;
②F和CO2反应产生Na2CO3和O2,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2;
③D和E发生的化学反应是氮气与氢气合成氨气,反应的方程式为N2+3H2![]() 2NH3;
2NH3;
④I和J的反应是氨气与HCl化合形成NH4Cl,反应的化学方程式为HCl+NH3=NH4Cl;
(3)化合物G与I发生的反应是HCl与Na2CO3反应产生NaCl、H2O、CO2,根据离子方程式拆分原则,可得该反应的离子方程式为CO32-+2H+=CO2↑+H2O。


科目:高中化学 来源: 题型:
【题目】“二![]() 英”是二苯基1,4二氧六环及其衍生物的通称,其中一种毒性最大的结构是
英”是二苯基1,4二氧六环及其衍生物的通称,其中一种毒性最大的结构是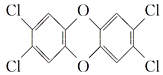 ,关于这种物质的叙述中不正确的是( )
,关于这种物质的叙述中不正确的是( )
A. 该物质不属于芳香族化合物
B. 该物质是一种卤代烃
C. 1 mol该物质最多可与6 mol H2在一定的条件下发生反应
D. 该物质分子中所有原子可能处在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
以芳香烃A为原料发生如下图所示的变化,可以合成两种高聚物G和H。已知:两个羟基连在同一碳原子上不稳定,会自动脱水。

回答下列问题:
(1)A 中官能团的名称是_____________;C的结构简式为_____________。
(2)B→C的反应条件是____________,D→E的反应类型是_______________。
(3)写出E→G 的化学方程式:_____________________。
(4)E的同分异构体中,苯环上有4 个取代基、遇FeCl3溶液显紫色且能与碳酸氢纳溶液反应生成 CO2的共 有__________种(不考虑立体异构),其中核磁共振氢谱显示有4 种不同化学环境的氢的结构简式为_____________(写出一种即可)。
(5)参照上述合成路线,以丙炔为原料(无机试制任选),设计可降解塑料聚乳酸(PLA)的合成路线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按图下装置进行制取。
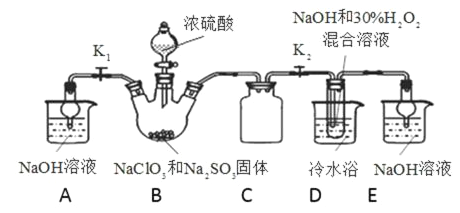
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,38-60℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是__________________________________。
(2)B中产生的ClO2是__________(填“氧化产物”或“还原产物”)。
(3)装置D中反应生成NaClO2的化学方程式为____________________________。反应后的溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH—外还可能含有SO42-,检验SO42-离子的方法是________________。
实验Ⅱ:样品杂质分析与纯度测定
(4)测定样品中NaClO2的纯度。测定时进行如下实验:准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是__________________________________________________。
②所称取的样品中NaClO2的物质的量为______________(用含c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B,C形成电子总数为10的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数为18的气体分子。请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关);
(1)A~F六种元素原子,原子半径最大的是_____(填元素符号),B元素在元素周期表中的位置________。
(2)D与E可形成化合物D2E,该化合物的电子式为________。
(3)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜单质反应,该反应的化学方程式为__________。
(4)比较E、F气态氢化物的较稳定的是:________(用分子式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com