
【题目】现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B,C形成电子总数为10的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数为18的气体分子。请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关);
(1)A~F六种元素原子,原子半径最大的是_____(填元素符号),B元素在元素周期表中的位置________。
(2)D与E可形成化合物D2E,该化合物的电子式为________。
(3)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜单质反应,该反应的化学方程式为__________。
(4)比较E、F气态氢化物的较稳定的是:________(用分子式表示)。
【答案】Na 第二周期VA族 ![]() Cu+2H2SO4(浓)
Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O HCl
CuSO4+SO2↑+2H2O HCl
【解析】
A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A能与C形成电子总数为10的分子,A与C形成的化合物常温下为液态,该化合物为水,则A为H元素、C为O元素;A、B的最外层电子数之和与C的最外层电子数相等,B的最外层电子数为:6-1=5,B的原子序数小于O,则B为N元素;A、D同主族,D的原子序数大于O,则D为Na元素;C与E同主族,则E为S元素;D、E、F同周期,A能分别与E、F形成电子总数为18的气体分子,则F为Cl元素,则:A为H元素、B为N元素、C为O元素、D为Na元素、E为S元素、F为Cl元素。
(1)同周期随原子序数增大原子半径减小,同主族电子层数越多原子半径越大,所以Na原子半径最大;B为N元素,其原子序数为7,最外层有5个电子,含有2个电子层,位于周期表中第二周期VA族,
答案:Na;第二周期VA族;
(2)D为Na元素、E为S元素,D与E可形成化合物Na2S,硫化钠为离子化合物,该化合物的电子式为![]() ;
;
答案:![]() ;
;
(3)A为H元素,C为O元素,E为S元素;三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜反应,该化合物为H2SO4,该反应的化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
答案:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(4)E为S元素、F为Cl元素,非金属性越强,其氢化物越稳定,则二者氢化物稳定性大小为:HCl>H2S;
答案为HCl


科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体,化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应。

请回答下列问题:
(1)写出下列物质化学式:A_______C________D________
(2)写出下列物质间反应的化学方程式:
①A+B____________________;②F+CO2________________
③D+E___________________________;④I+J___________________
(3)写出下列反应的离子方程式G+I________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取三张蓝色石蕊试纸湿润后贴在玻璃片上,然后按顺序分别滴加65%硝酸溶液、98%的硫酸溶液、新制氯水,三张试纸最终变成( )
A. 白、红、白 B. 红、黑、白
C. 红、红、红 D. 白、黑、白
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O,下列说法正确的是
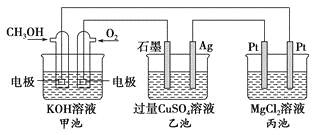
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D. 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g) ![]() CH3OH(g),△H1
CH3OH(g),△H1
反应Ⅱ:CO2(g)+3H2(g) ![]() CH3OH(g)+ H2O(g),△H2
CH3OH(g)+ H2O(g),△H2
下表所列数据是反应I在不同温度下的化学平衡常数(K):
温度 | 250℃ | 300℃ | 350℃ |
K | 2.0 | 0.27 | 0.012 |
(1)在一定条件下将2 molCO和6molH2充入2L的密闭容器中发生反应I,5min后测得c(CO)=0.4 mol/L,计算此段时间的反应速率(用H2表示)___________ mol/(L·min)。
(2)由表中数据判断△H1_____0(填“>”、“<”或“=”)反应,C02(g)+H2(g)![]() CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
(3)若容器容积不变,下列措施可提高反应Ⅰ中CO转化率的是_________(选字母)。
a.充入CO,使体系总压强增大
b.将CH3OH(g)从体系中分离
e.充入He,使体系总压强增大
d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:K=_________;保持恒温恒容的条件下将反应Ⅱ的平衡体系各物质浓度均增加一倍,则化学平衡_________(填“正向”、“逆向”或“不”)移动,平衡常数K____(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硝酸的叙述正确的是( )
A. NO2溶于水生成硝酸,所以NO2是酸性氧化物
B. 硝酸可与活泼金属反应生成盐和氢气
C. 常温下铁与浓硝酸反应,产生大量的红棕色气体
D. 硝酸与铜的反应既表现出氧化性又表现出酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。
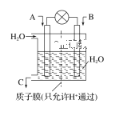
(1)利用电化学原理将CO、SO2转化为重要化工原料,装置如图所示:
①若A为CO,B为H2,C为CH3OH,则通入CO的一极为________极。
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为________________________________________________________________________。
③若A为NO2,B为O2,C为HNO3,则正极的电极反应式为________________________________________________________________________。
(2)碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650 ℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1∶1)直接作燃料,其工作原理如图所示。
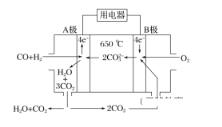
①电池总反应为________________________________________________________________________。
②以此电源电解足量的硝酸银溶液,若阴极产物的质量为21.6 g,则阳极产生气体标准状况下体积为______ L。电解后溶液体积为2 L,溶液的pH约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某充电宝锂离子电池的总反应为:xLi + Li1-xMn2O4![]() LiMn2O4,某手机镍氢电池总反应为:NiOOH + MH
LiMn2O4,某手机镍氢电池总反应为:NiOOH + MH![]() M+ Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是:
M+ Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是:

A. 锂离子电池放电时Li+向正极迁移
B. 镍氢电池放电时,正极电极反应式:NiOOH+H2O +e-==Ni(OH)2+OH-
C. 上图表示用锂离子电池给镍氢电池充电
D. 锂离子电池充电时,阴极的电极反应式: LiMn2O4—xe-== Li1-xMn2O4+ xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝原子与氯气反应时失去3个电子,钠原子与氯气反应时失去1个电子,由此得出的下列结论中不正确的是( )
A.铝的活泼性比钠的活泼性强
B.不能说明铝和钠活泼性的强弱
C.在生成的氯化物中钠元素为+1价
D.在生成的氯化物中铝元素为+3价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com