
【题目】下列有关溶液![]() 室温下
室温下![]() 的说法正确的是
的说法正确的是![]()
A.![]() 和
和![]() 形成的混合溶液中:
形成的混合溶液中:![]()
B.![]() 溶液中通入
溶液中通入![]() 至溶液
至溶液![]() :
:![]()
C.物质的量浓度相等的![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液中,
溶液中,![]() 的大小关系:
的大小关系:![]()
D.![]() 溶液中通入HCl至溶液
溶液中通入HCl至溶液![]() :
:![]()
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g)![]() 2NO2(g) ΔH<0,n(NO)随时间的变化如下表:
2NO2(g) ΔH<0,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)下图中表示NO2的变化的曲线是_____。用O2表示从0~2 s内该反应的平均速率v=____。

(2)能说明该反应已达到平衡状态的是____。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在科学家正在寻求将太阳能转化成化学能的方法,其中之一就是利用太阳能将![]() 分解成
分解成![]() ,再将化学能转化为其他能源。下面是有关的能量循环示意图,下列有关说法正确的是
,再将化学能转化为其他能源。下面是有关的能量循环示意图,下列有关说法正确的是
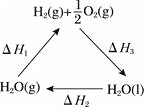
A.图中![]()
B.如果![]() 的键能为
的键能为![]() ,
,![]() 键能为
键能为![]() ,则断开
,则断开![]() 水蒸气中
水蒸气中![]() 键所需要的太阳能为
键所需要的太阳能为![]()
C.![]() 燃烧热为
燃烧热为![]()
D.水蒸气所具有的能量比液态水多![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处于平衡状态的反应2H2S(g)![]() 2H2(g)+S2(g) ΔH>0,合理的说法是( )
2H2(g)+S2(g) ΔH>0,合理的说法是( )
A. 加入催化剂,反应途径将发生改变,ΔH也将随之改变
B. 升高温度,正逆反应速率都增大,H2S分解率也增大
C. 增大压强,平衡向逆反应方向移动,将引起体系温度降低
D. 若体系恒容,注入一些H2后达新平衡,H2浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用浓度为0.100 0 mol·L-1的氢氧化钠溶液分别滴定20.00 mL浓度均为0.100 0 mol·L-1的二种酸HX、HY(忽略体积变化),实验数据如下表,下列判断不正确的是 ( )
数据编号 | 滴入NaOH(aq)的体积/mL | 溶液的pH | |
HX | HY | ||
① | 0 | 3 | 1 |
② | a | 7 | x |
③ | 20.00 | >7 | y |
A. 在相同温度下,同浓度的两种酸溶液的导电能力:HX<HY
B. 由表中数据可估算出Ka(HX)≈10-5
C. HY和HX混合,c(H+)=c(X-)+c(Y-)+c(OH-)
D. 上述②反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池,如图所示。
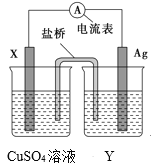
请回答下列问题:
(1)电极X的材料是___;电解质溶液Y是___。
(2)银电极为电池的___极,发生的电极反应为___。X电极上发生的电极反应为___。
(3)外电路中的电子是从____极流向___极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,XOH、YOH及ZOH三种一元碱的物质的量浓度均为0.100 mol·L-1,体积均为10.00 mL,分别用0.100 mol·L-1的HCl溶液滴定,滴定曲线如图所示。下列说法正确的是
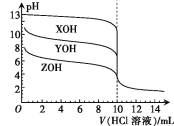
A.均可用酚酞作指示剂
B.电离平衡常数:Kb(YOH)<Kb(ZOH)
C.均滴入10.00 mL HCl溶液时,ZCl溶液中的水解程度最大
D.pH=11的YOH与pH=3的HCl溶液等体积混合:c(Cl-)>c(Y+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是(NA表示阿伏加德罗常数)( )
A.常温c(OH-)/c(H+)=10-13的溶液中可能含有K+、Fe2+、NO3-、Cl-四种离子
B.1 L 0.1molL-1的CH3COONa溶液中CH3COO-和OH-的总数大于0.1NA
C.电子工业上用30%的氯化铁溶液腐蚀敷在印刷线路板上的铜箔:Fe3+ +Cu = Fe2++Cu2+
D.H2的燃烧热为a kJ·mol-1,H2燃烧热的热化学方程式为:O2(g) +2H2(g) = 2H2O(l) ΔH = -2a kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表中第四周期的部分元素![]() 从左到右按原子序数递增排列
从左到右按原子序数递增排列![]() ,根据要求回答下列问题:
,根据要求回答下列问题:
K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
(1)以上元素的基态原子的电子排布中,4s轨道上只有1个电子的元素有______![]() 填元素名称
填元素名称![]() 。
。
(2)以上元素中,属于s区的元素有_________种,属于d区的元素有______种。
(3)第一电离能![]() ________
________![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”,下同
”,下同![]() 。
。
(4)现有含钛的两种颜色的晶体,![]() 的配位数均为6,一种为紫色,一种为绿色,相关实验证明,两种晶体的组成皆为
的配位数均为6,一种为紫色,一种为绿色,相关实验证明,两种晶体的组成皆为![]() 。为测定这两种晶体的化学式,设计了如下实验:
。为测定这两种晶体的化学式,设计了如下实验:
![]() 分别取等质量的两种配合物晶体的样品配成待测溶液;
分别取等质量的两种配合物晶体的样品配成待测溶液;
![]() 分别往待测溶液中滴入
分别往待测溶液中滴入![]() 溶液,均产生白色沉淀;
溶液,均产生白色沉淀;
![]() 溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的![]() 。试推断紫色晶体的化学式为_________。
。试推断紫色晶体的化学式为_________。
(5)含有元素K的盐的焰色反应为__________色。许多金属盐都可以发生焰色反应,其原因是____________。
(6)立方氮化硼晶体![]() ,是一种超硬材料,有优异的耐磨性,其晶胞如图所示。
,是一种超硬材料,有优异的耐磨性,其晶胞如图所示。
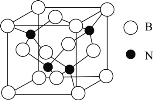
若立方氮化硼晶胞的边长为![]() ,则立方氮化硼的密度为________g/cm3
,则立方氮化硼的密度为________g/cm3![]() 只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA)。
只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com