
| 1×10-13 |
| 1×10-11 |
| 1×10-13 |
| 1×10-11 |
| 0.1mol/L×V2L-0.01mol/L×V1L |
| V1L+V2L |
| 0.01mol/L×2V |
| (2+9)V |
| 0.02 |
| 11 |
0.1mol/L×
| ||
| (2+9)V |
| 0.45 |
| 11 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| A、在相同温度下,用不同催化剂时,消耗NH3的平均速率相同 |
| B、上述反应都是吸热反应 |
| C、生成N2的选择性,MnO2选择性最差 |
| D、将NO转化为N2适宜的温度约为400K,用Mn3O4做催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
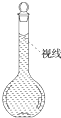 实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1:1 |
| B、1:2:1 |
| C、2:3:1 |
| D、2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
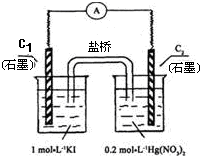
| A、C1电极上发生的反应是:2I--2e-=I2 |
| B、如图装置的电流方向是从C1到C2 |
| C、盐桥中的K+离子向C1电极移动 |
| D、装置发生的总反应是Hg2++2I-=HgI2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操 作 步 骤 | 现 象 及 结 论 | |
| 方法一 | ||
| 方法二 |
查看答案和解析>>
科目:高中化学 来源: 题型:
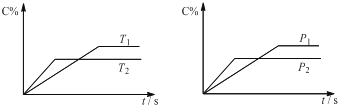
| A、达到平衡后,加入催化剂则C%增大 |
| B、达到平衡后,若升高温度,平衡正向移动 |
| C、a可以为任意的正整数 |
| D、达平衡后,增加A的量,有利于平衡正向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com