
【题目】对于可逆反应N2(g)+3H2(g)2NH3(g);△H<0,下列研究目的和示意图相符的是
A | B | C | D | |
研究目的 | 压强对反应的影响(p2>p1) | 温度对反应的影响 | 增加H2的浓度对反应的影响 | 催化剂对反应的影响 |
图示 |
|
|
|
|
A.AB.BC.CD.D
【答案】C
【解析】
A.图片显示:p1压强下反应先到达平衡,故p1压强下,反应速率更大,到达平衡的时间更短,故p1>p2,A错误;
B.温度升高,平衡N2(g)+3H2(g)2NH3(g)逆向移动,N2(g)的转化率减小,图示显示升高温度,N2(g)的转化率增大,B错误;
C.突然增大氢气的浓度,正反应速率突然增大,此时氨气的浓度不变,逆反应速率不变,正反应速率大于逆反应速率,平衡正向移动。随着反应的进行,氢气的浓度减小,正反应速率减小,氨气的浓度增大,逆反应速率增大,某时刻,正反应速率和逆反应速率重新相等,反应达到新的平衡,C正确;
D.催化剂能加快反应速率,缩短到达平衡的时间,图示不符,D错误。
答案选C。


科目:高中化学 来源: 题型:
【题目】室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
A. 溶液中导电粒子的数目减少
B. 溶液中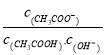 不变
不变
C. 醋酸的电离程度增大,C(H+)亦增大
D. 再加入10mlpH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿斯巴甜是一种具有清爽甜味的有机化合物,结构简式如图所示。下列说法不正确的是( )
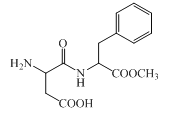
A.分子式为C14H18N2O5
B.不存在顺反异构
C.能发生取代和消去反应
D.1 mol阿斯巴甜完全水解最多消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,△H1>△H2的是
①C(s)+O2(g)=CO2(g) △H1 C(s)+![]() O2(g)=CO(g) △H2
O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H1 S(g)+O2(g)=SO2(g) △H2
③H2(g)+![]() O2(g)=H2O(l) △H1 2H2(g)+O2(g)=2H2O(l) △H2
O2(g)=H2O(l) △H1 2H2(g)+O2(g)=2H2O(l) △H2
④CaCO3(s)=CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)=Ca(OH)2(s) △H2
A.①B.④C.②③④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的铁粉加入到一定浓度的稀硝酸中,金属恰好完全溶解,反应后溶液中存在:![]() ,则参加反应的Fe和HNO3的物质的量之比为( )
,则参加反应的Fe和HNO3的物质的量之比为( )
A.5∶16B.1∶1C.2∶3D.3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组粒子在溶液中可以大量共存,且加入或通入试剂M后,发生反应的离子方程式也正确的是
选项 | 微粒组 | 试剂M | 发生反应的离子方程式 |
A | K+、Na+、 | 少量HCl | 2H++ |
B |
| 过量H2S | Fe2++H2S |
C | HClO、Na+、Fe3+、 | 过量CaCl2 | Ca2++ |
D |
| 少量CO2 | CO2+2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率.
(1)氢气在O2中燃烧的反应是______热反应(填“放”或“吸”),这是由于反应物的总能量______生成物的总能量(填“大于”、“小于”或“等于”,下同);
(2)从化学反应的本质角度来看,氢气的燃烧是由于断裂反应物中的化学键吸收的总能量______形成产物的化学键放出的总能量。已知破坏1mol H-H键、1mol O=O键、1mol H-O键时分别需要吸收a kJ、b kJ、c kJ的能量。则2mol H2(g)和1mol O2(g)转化为2mol H2O(g)时放出的热量为
____________________kJ。
(3)通过氢气的燃烧反应,可以把氢气中蕴含的化学能转化为热能,如果将该氧化还原反应设计成原电池装置,就可以把氢气中蕴含的化学能转化为电能,下图就是能够实现该转化的装置(其中电解质溶液为KOH溶液),被称为氢氧燃料电池.该电池的正极是___(填a或b),负极反应式为______________。
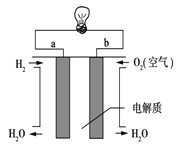
(4)若将右图中的氢氧燃料电池用固体金属氧化物陶瓷作电解质(能够传导O2-),已知正极上发生的电极反应式为:O2+4e-===2O2-则负极上发生的电极反应式为________;电子从________极(填a或b)流出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A. 0.1 mol·L1NaOH溶液:Na+、K+、![]() 、
、![]()
B. 0.1 mol·L1FeCl2溶液:K+、Mg2+、![]() 、
、![]()
C. 0.1 mol·L1K2CO3溶液:Na+、Ba2+、Cl、OH
D. 0.1 mol·L1H2SO4溶液:K+、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置探究NH3和CuSO4溶液的反应。
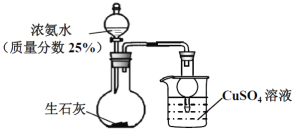
(1)上述制备NH3的实验中,烧瓶中反应涉及到多个平衡的移动:NH3+H2O![]() NH3H2O、____________、_________________(在列举其中的两个平衡,可写化学用语也可文字表述)。
NH3H2O、____________、_________________(在列举其中的两个平衡,可写化学用语也可文字表述)。
(2) 制备100mL25%氨水(ρ=0.905gcm-3),理论上需要标准状况下氨气______L(小数点后保留一位)。
(3) 上述实验开始后,烧杯内的溶液__________________________,而达到防止倒吸的目的。
(4)NH3通入CuSO4溶液中,产生蓝色沉淀,写出该反应的离子方程式。_______________________。继续通氨气至过量,沉淀消失得到深蓝色[Cu(NH3)4]2+溶液。发生如下反应:2NH4+(aq)+Cu(OH)2(s)+2NH3(aq)![]() [Cu(NH3)4]2+(aq)(铜氨溶液)+2H2O+Q(Q>0)。
[Cu(NH3)4]2+(aq)(铜氨溶液)+2H2O+Q(Q>0)。
①该反应平衡常数的表达式K=___________________________。
②t1时改变条件,一段时间后达到新平衡,此时反应K增大。在下图中画出该过程中v正的变化___________________。
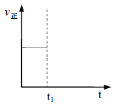
③向上述铜氨溶液中加水稀释,出现蓝色沉淀。原因是:________________________________。
④在绝热密闭容器中,加入NH4+(aq)、Cu(OH)2和NH3(aq)进行上述反应,v正随时间的变化如下图所示,v正先增大后减小的原因__________________________________。
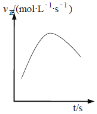
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com