
【题目】用酸式滴定管准确移取25.00mL,某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.20molL﹣1的氢氧化钠溶液(指示剂为酚酞)滴定得结果如表
NaOH起始读数 | NaOH终点读数 | |
第一次 | 0.10ml | 20.30ml |
第二次 | 0.30ml | 20.10ml |
(1)根据以上数据可以计算出盐酸的物质的量浓度为 molL﹣1 .
(2)在配制250mL0.20molL﹣1的氢氧化钠标准溶液时,用到的仪器除托盘天平、烧杯、玻璃棒还有 .
(3)以下操作造成测定结果偏高的有 .
A.配制标准溶液的氢氧化钠固体中混有KOH杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.
【答案】
(1)0.16
(2)250mL容量瓶、胶头滴管
(3)D,E
【解析】解:(1)第一次滴定消耗标准液体积为:20.30mL﹣0.10mL=20.2mL,第二次滴定消耗标准液的体积为:20.10mL﹣0.30mL=19.80mL,则两次滴定消耗标准液的平均体积为: ![]() =20.00mL,
=20.00mL,
该元素的物质的量浓度为:c(HCl)= ![]() =
= ![]() =0.16mol/L,
=0.16mol/L,
所以答案是:0.16;
(2)在配制250mL0.20molL﹣1的氢氧化钠标准溶液时,用到的仪器除托盘天平、烧杯、玻璃棒,还有规格为250mL的容量瓶及定容时使用的胶头滴管,
所以答案是:250mL容量瓶、胶头滴管;
(3)A.所用的固体KOH中混有NaOH,相同质量的氢氧化钠和氢氧化钾,氢氧化钠的物质的量大于氢氧化钾的物质的量,故所配得溶液的OH﹣浓度偏大,造成V(碱)偏小,根据c(酸)= ![]() 可知c(酸)偏低,故A错误;
可知c(酸)偏低,故A错误;
B.滴定终点读数时,俯视滴定管的刻度,造成V(碱)偏低,根据c(酸)= ![]() 可知c(酸)偏低,故B错误;
可知c(酸)偏低,故B错误;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,不一定滴定结果,故C错误;
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液,造成V(碱)偏大,根据c(酸)= ![]() 可知c(酸)偏高,故D正确;
可知c(酸)偏高,故D正确;
E.未用标准液润洗碱式滴定管,导致标准液被稀释,滴定时消耗标准液体积偏大,测定结果偏高,故E正确;
所以答案是:DE.
【考点精析】利用酸碱中和滴定对题目进行判断即可得到答案,需要熟知中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点.


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 需要加热才能发生的化学反应都是吸热反应
B. 应用盖斯定律可以计算某些难以测量的反应焓变
C. 任何能使熵值增大的过程都能自发进行
D. 化学平衡发生移动,平衡常数一定发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(g)cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )
A.达平衡后,若升温,平衡左移
B.达平衡后,加入催化剂则C%增大
C.化学方程式中a+b>c+d
D.达平衡后,减少A的量有利于平衡向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数为6.02×1023mol-1 。关于1mol H2O的叙述正确的是
A.含有1mol H2B.含有6.02×1023个水分子
C.质量为18 g/molD.在标准状况下的体积为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代《本草纲目》中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上…其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( )
A.萃取B.蒸发C.蒸馏D.升华
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度为 0.1mol/L、体积为 V L 的氨水中逐滴加入 0.1mol/L 的盐酸,下列 各选项中数值变大的有( )
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将乙酸溶液与NaOH溶液混合,所得溶液的pH=7,则此溶液中
A. c(CH3COO-)>c(Na+)
B. c(CH3COO-)<c(Na+)
C. c(CH3COO-)=c(Na+)
D. 无法确定c(CH3COO-)与c(Na+)的大小关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含碳的化合物之间很容易发生转化.请回答下列问题:
(1)有机物 M 在有光的时候很容易转化成 N,其过程如图: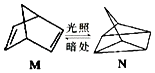
M 到 N 过程中,光能转化为能;其中较稳定的物质是(用 M、N 回答).
(2)已知 ![]() (l)的燃烧热为 3267.5kJmol﹣1 ,
(l)的燃烧热为 3267.5kJmol﹣1 , ![]() (l)+6O 2(g)═6CO2 (g)+3H2 (g)
(l)+6O 2(g)═6CO2 (g)+3H2 (g)
△H=a kJmol﹣1 , 则 a﹣3267.5(填“>”、“<”或“=”).
(3)在标准状态即压力为 100kPa,一定温度下,由元素最稳定的单质生成生成 1mol 纯化 合物时的反应热称为该化合物的标准摩尔生成焓(△H¢).已知 100kPa,一定温度下:
Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=+490.0kJmol﹣1
CO(g)+ ![]() O2(g)=CO 2(g)△H=﹣280.0kJmol﹣1
O2(g)=CO 2(g)△H=﹣280.0kJmol﹣1
C(石墨)+O2(g)=CO2 (g)△H=﹣390.5kJmol﹣1
则 Fe2O3的标准摩尔生成焓△H= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图装置制取少量乙酸乙酯,下列说法正确的是

A. 实验时向a中先加浓硫酸再加乙醇和乙酸
B. 加入浓硫酸并加热起到了加快反应速率的作用
C. 试管b中试剂为饱和NaOH溶液,可除去乙酸和乙醇
D. 实验结束时,采用蒸发的方法将乙酸乙酯从混合物中分离出来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com