
【题目】元素X位于第四周期,其基态原子有4个未成对电子.Y原子最外层电子数是其内层电子总数的3倍,元素Z基态原子的3p轨道上有4个电子.
(1)Y与Z可形成多种化合物. ①元素Y与Z中电负性较大的是(用元素符号描述).
②离子ZY32﹣的空间构型为(用文字描述).
③写出一种与ZY2互为等电子体的氧化物分子的化学式 .
(2)Y的氢化物(H2Y)在乙醇中的溶解度大于H2Z,其原因是 .
(3)含X2+的溶液与KCN、氨水反应可得到化合物K3[X(CN)5(NH3)]. ①基态X2+的电子排布式是
②1mol配合物K3[X(CN)5(NH3)]中含σ键的数目为 .
(4)下图为X与Z所形成的一种化合物的基本结构单元,推测该化合物的化学式: . 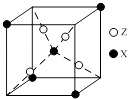
【答案】
(1)O;三角锥形;SeO2
(2)H2O分子与乙醇分子间可形成氢键,而H2S不能
(3)1s22s22p63s23p63d6;14mol
(4)Fe3S8
【解析】解:元素X位于第四周期,其基态原子有4个未成对电子,核外电子排布式为1s22s22p63s23p63d64s2 , 则X为Fe;Y原子最外层电子数是其内层电子总数的3倍,原子只能有2个电子层,最外层电子数为6,故Y为O元素;元素Z基态原子的3p轨道上有4个电子,核外电子排布式为1s22s22p63s23p4 , 则Z为S元素.(1)①同主族自上而下电负性减小,故电负性O>S,所以答案是:O;②离子SO32﹣中S原子孤电子对数= ![]() =1,价层电子对数=3+1=4,为三角锥形,所以答案是:三角锥形;
=1,价层电子对数=3+1=4,为三角锥形,所以答案是:三角锥形;
③原子数目相等、价电子总数也相等的微粒互为等电子体,则一种与SO2互为等电子体的氧化物分子的化学式为:SeO2等,所以答案是:SeO2;(2)H2O分子与乙醇分子间可形成氢键,而H2S不能,H2O在乙醇中的溶解度大于H2S,
所以答案是:H2O分子与乙醇分子间可形成氢键,而H2S不能;(3)①基态Fe2+的电子排布式是:1s22s22p63s23p63d6 , 所以答案是:1s22s22p63s23p63d6;
②氨气分子中有3个σ键,CN﹣中含有1个σ键,形成6个配位键,也属于σ键,1mol配合物K3[Fe(CN)5(NH3)]中含14molσ键,所以答案是:14mol;(4)根据均摊法,晶胞中S原子数目为4,Fe原子数目为1+4× ![]() =1.5,Fe、S原子数目之比为3:8,故化学式为:Fe3S8 , 所以答案是:Fe3S8 .
=1.5,Fe、S原子数目之比为3:8,故化学式为:Fe3S8 , 所以答案是:Fe3S8 .


科目:高中化学 来源: 题型:
【题目】磷能形成多种含氧酸.
(1)次磷酸(H3PO2)是一种精细化工产品,向10mL H3PO2溶液中加入20mL等物质的量浓度的NaOH溶液后,所得的溶液中只有H2PO2﹣、OH﹣两种阴离子.
①写出H3PO2溶液与足量NaOH 溶液反应后形成的正盐的化学式: , 该正盐溶液中各离子浓度由大到小的顺序为 .
②若25℃时,c(H3PO2)=1×10﹣2 , 则0.01molL﹣1的H3PO2溶液的pH=
(2)亚磷酸(H3PO3)是二元中强酸,25℃时亚磷酸的电离常数为K1=1×10﹣2、K2=2.6×10﹣7 .
①试从电离平衡移动的角度解释K1、K2数据的差异
②NaH2PO3溶液显性(填“酸”“碱”或“中”).
(3)25℃时,HF的电离常数为K=3.6×10﹣4; H3PO4的电离常数为K1=7.5×10﹣3 , K2=6.2×10﹣8 , K3=4.4×10﹣13 . 足量NaF溶液和H3PO4溶液反应的离子方程式为
(4)相同温度下,等物质的量浓度的上述三种磷的含氧酸中.c(H+)由大到小的顺序为(用酸的分子式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中配制碘水,往往是将I2溶于KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+ I![]()
![]()
上述平衡体系中,![]() 的物质的量浓度c(
的物质的量浓度c(![]() )与温度T的关系如图所示(曲线上的任何一点都表示平衡状态):
)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态):

(1)通过分析上图,该反应的正反应为 反应(填“吸热”或“放热”)。
(2)在T1温度D状态时,v正 v逆(填“>”“<”或“=”);若在T1时某状态![]() =
=![]() , 平衡状态(填“是”“不是”或“不一定是”)。
, 平衡状态(填“是”“不是”或“不一定是”)。
(3)写出该平衡常数的表达式K = 。若升高温度,K值将 (填“增大”或“减小”或“不变”,下同);若向溶液中加入少量的溴水,K值将 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种治疗认知障碍药物的中间体,可以通过以下方法合成: 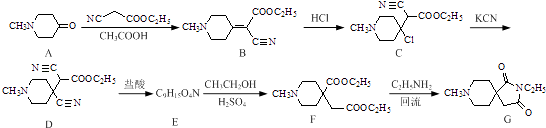
(1)化合物A,D中含氧官能团的名称分别为和 .
(2)由B→C的反应类型为;化合物E的结构简式为 .
(3)写出同时满足下列条件的B的一种同分异构体的结构简式: . ①能发生银镜反应,水解产物之一能与FeCl3溶液发生显色反应;
②分子中只有4种不同化学环境的氢,且分子中含有氨基.
(4)已知:RCN ![]() RCH2NH2 , 请写出以
RCH2NH2 , 请写出以 ![]() 和CH3CH2Cl为原料制备
和CH3CH2Cl为原料制备 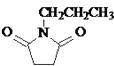 的合成路线流程图(无机试剂任用).合成路线流程图示例如下: CH3CH2OH
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: CH3CH2OH ![]() CH2=CH2
CH2=CH2 ![]() CH3CH2Cl.
CH3CH2Cl.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液.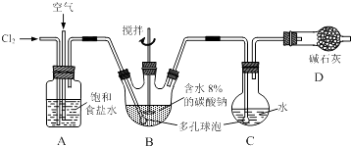
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8℃,42℃以上分解为Cl2和O2 .
(1)①实验中控制氯气与空气体积比的方法是 .
②为使反应充分进行,实验中采取的措施有 .
(2)①装置B中产生Cl2O的化学方程式为: .
②若B无冷却装置,则进入C中的Cl2O会大量减少.其原因是 .
(3)装置C中采用棕色圆底烧瓶是因为 .
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl﹣ . 测定C中次氯酸溶液的物质的量浓度的实验方案为:用取20.00mL次氯酸溶液, . (可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液.除常用仪器外须使用的仪器有:电子天平,真空干燥箱)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向V mL pH=a的盐酸中,滴加10V mL pH=b的NaOH溶液,所得溶液中Cl﹣的物质的量恰好等于Na+的物质的量,则a+b的值是( )
A.15
B.14
C.13
D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应热的叙述中正确的是( )
①已知2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJmol﹣1 , 则氢气的燃烧热为△H=﹣241.8kJmol﹣1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)═Z(g)+W(s)△H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
④已知:
共价键 | C﹣C | C═C | C﹣H | H﹣H |
键能/(kJmol﹣1) | 348 | 610 | 413 | 436 |
上表数据可以计算出 ![]() (g)+3H2(g)→
(g)+3H2(g)→ ![]() (g)的反应热;
(g)的反应热;
⑤由盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1molCO2固体时,放出的热量相等;
⑥25℃,101kPa时,1mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热.
A.①②③④
B.③④⑤
C.④⑤
D.⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜与稀硫酸不发生反应,但如果在铜与稀硫酸的混合溶液中加入某种盐,就能使铜溶解,且有气体产生,则该盐是:( )
A. Na2CO3 B. KNO3 C. CuCl2 D. BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:
①2Fe2O3(s)+3C(s)4Fe(s)+3CO2(g)△H=+460.5KJmol﹣1
②Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)△H=﹣28.5KJmol﹣1
③断裂1mol CO(s)气体中的化学键需要吸收1076KJ的能量
断裂1mol CO2(s)气体中的化学键需要吸收1490KJ的能量
请回答:
(1)断裂1mol C(s)中所有化学键需要吸收的能量为 .
(2)T1℃时,向密闭容器中加入一定量的Fe2O3和C,发生反应①,达到平衡后,CO2的浓度为a molL﹣1;其他条件不变,缩小容器容积,再次达到平衡时,CO2的浓度为b molL﹣1 , 则a(选填“>”“<”或“=”)b.
(3)起始温度均为T2℃时,向容积为10L的三个恒容密闭容器中,分别加入一定量的Fe2O3和CO发生反应②,测得相关数据如表所示:
编号 | 容器 | 起始时物质的量 mol | 平衡时物质的量/mol | 平衡常数(K) | |
Fe2O3 | CO | Fe | |||
1 | 恒温 | 0.5 | 1.5 | 0.8 | K1 |
2 | 恒温 | 2 | 3 | m | K2 |
3 | 绝热 | 1 | 1.5 | n | K3 |
①T2℃时,容器1中反应的平衡常数K1= .
②容器2中,5min达到平衡,则0~5min内以CO2表示该反应的速率v(CO2)= .
③对于三个容器中的反应,下列说法正确的是(填选项字母).
A.m>2n
B.容器1和容器2中CO的平衡转化率v1<v2 .
C.K1=K3
D.平衡时气体压强:P3>P1
(4)T2℃时,向恒压密闭容器中充入0.5mol Fe2O3和1.0mol CO,发生反应②,CO和CO2的物质的量浓度(c)与时间(t)的关系如图1所示. 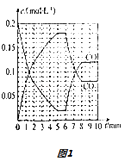
①6min时,改变的外界条件未 , 理由为 .
②10min时,再向容器中加入1 mol Fe2O3、1 mol CO、1 mol Fe、1 mol CO2、起始的反应速率v(正)(选填“>”“<”或“=”)v(逆).
(5)CO﹣O2熔融盐燃料电池的装置如图2所示,电池工作时,C口产生的气体一部分通入B口被利用,另一部分被分离出来,若导线中流过2mole﹣ , 理论上C口被分离出的气体的物质的量最多为 . 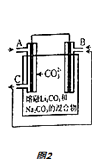
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com