
����Ŀ��ʵ���������Ƶ�ˮ�������ǽ�I2����KI��Һ�У������Ϳ��Եõ�Ũ�Ƚϴ�ĵ�ˮ����Ҫ����Ϊ�����˷�Ӧ��I2(aq)+ I![]()
![]()
����ƽ����ϵ�У�![]() �����ʵ���Ũ��c(
�����ʵ���Ũ��c(![]() )���¶�T�Ĺ�ϵ��ͼ��ʾ(�����ϵ��κ�һ�㶼��ʾƽ��״̬)��
)���¶�T�Ĺ�ϵ��ͼ��ʾ(�����ϵ��κ�һ�㶼��ʾƽ��״̬)��

��1��ͨ��������ͼ���÷�Ӧ������ӦΪ ��Ӧ(����ȡ����ȡ�)��
��2����T1�¶�D״̬ʱ��v�� v��(�>����<����=��)������T1ʱij״̬![]() =
=![]() �� ƽ��״̬(��ǡ������ǡ���һ���ǡ�)��
�� ƽ��״̬(��ǡ������ǡ���һ���ǡ�)��
��3��д����ƽ�ⳣ���ı���ʽK = ���������¶ȣ�Kֵ�� (�����С�����䡱����ͬ)��������Һ�м�����������ˮ��Kֵ�� ��
���𰸡���1������ ��2�� �� ��һ���� ��3��![]() ��С ����
��С ����
����������1�������⼰ͼ��֪��I2(aq)+I-![]()
![]() �������¶ȣ�c(
�������¶ȣ�c(![]() )��С��ƽ�����淴Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ�� ��2����T1�¶�D״̬ʱ��Ҫ�ﵽƽ��״̬A�㣬c(
)��С��ƽ�����淴Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ�� ��2����T1�¶�D״̬ʱ��Ҫ�ﵽƽ��״̬A�㣬c(![]() )������Ӧ������У���v����v����K=
)������Ӧ������У���v����v����K=![]() ����
����![]() =
=![]() ʱ����֪c(I2)�Ĵ�С������ȷ���Ƿ�ﵽƽ��״̬��
ʱ����֪c(I2)�Ĵ�С������ȷ���Ƿ�ﵽƽ��״̬��
��3��K=![]() �������¶ȣ�ƽ�������ƶ�����Kֵ��С��������������ˮ��ֻ�ı������ʵ�Ũ�ȣ���Kֵ���䡣
�������¶ȣ�ƽ�������ƶ�����Kֵ��С��������������ˮ��ֻ�ı������ʵ�Ũ�ȣ���Kֵ���䡣


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ��c(Cl-)������
A. 65mL1mol/L��KCl��Һ B. 25mL3mol/L��NaCl��Һ
C. 20mL2mol/L��MgCl2��Һ D. 10mL1.5mol/L��AlCl3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е��뷽��ʽ����ȷ���ǣ� ��
A.��������ˮ��CH3COOH�TCH3COO��+H+
B.Na2SO4����ˮ��Na2SO4�T2Na++SO42��
C.̼����������ˮ��NaHCO3�THCO3��+Na+
D.����������ˮ��HClOH++ClO��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ������������ǣ� �� 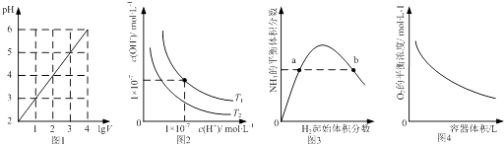
A.ͼ1��ʾ1 LpH=2��CH3COOH��Һ��ˮϡ����V L��pH��lgV�ı仯
B.ͼ2��ʾ��ͬ�¶���ˮ��Һ��H+��OH��Ũ�ȵı仯�����ߣ�ͼ���¶�T2��T1
C.ͼ3��ʾһ�������µĺϳɰ���Ӧ�У�NH3��ƽ�����������H2��ʼ���������N2����ʼ���㶨���ı仯��ͼ��a��N2��ת����С��b��
D.ͼ4��ʾͬһ�¶��£��ڲ�ͬ�ݻ��������н��з�Ӧ2BaO2��s��2BaO��s��+O2��g����O2��ƽ��Ũ���������ݻ��Ĺ�ϵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��Һ�п��ܴ������������������ ��
A. Na+��NO3-��K+��Fe2+ B. Cu2+��Na+��SO42-��K+
C. K+��I-��NO3-��Ca2+ D. OH-��NO3-��Na+��HCO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������뻹ԭ��ͬһԪ���н��е���
A��Cl2+2NaOH![]() NaCl+NaClO+H2O B��Fe+CuSO4
NaCl+NaClO+H2O B��Fe+CuSO4![]() FeSO4+Cu
FeSO4+Cu
C��2H2O![]() 2H2��+O2�� D��2KClO3
2H2��+O2�� D��2KClO3![]() 2KCl+3O2��
2KCl+3O2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��ֹ�л���ӷ����ɼ�һ��ˮ���棬��ˮ�⡣�����л����У�������ˮ�ⷨ���棬���ܷ���ˮ�����ȥ��Ӧ����
A.�Ҵ�B.������C.��������D.���Ȼ�̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ��Xλ�ڵ������ڣ����̬ԭ����4��δ�ɶԵ��ӣ�Yԭ�����������������ڲ����������3����Ԫ��Z��̬ԭ�ӵ�3p�������4�����ӣ�
��1��Y��Z���γɶ��ֻ���� ��Ԫ��Y��Z�е縺�Խϴ��������Ԫ�ط�����������
������ZY32���Ŀռ乹��Ϊ����������������
��д��һ����ZY2��Ϊ�ȵ��������������ӵĻ�ѧʽ ��
��2��Y���⻯�H2Y�����Ҵ��е��ܽ�ȴ���H2Z����ԭ���� ��
��3����X2+����Һ��KCN����ˮ��Ӧ�ɵõ�������K3[X��CN��5��NH3��]�� �ٻ�̬X2+�ĵ����Ų�ʽ��
��1mol�����K3[X��CN��5��NH3��]�к��Ҽ�����ĿΪ ��
��4����ͼΪX��Z���γɵ�һ�ֻ�����Ļ����ṹ��Ԫ���Ʋ�û�����Ļ�ѧʽ�� �� 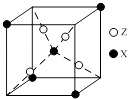
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij�¶��£�Ksp��AgCl��=1.56��10��10 �� Ksp��Ag2CrO4��=1��10��12 �� ���й��ڸ��¶��µ�������ȷ���ǣ� ��
A.���Ȼ���������Һ�м����Ȼ�����Һ��Ksp��AgCl�� ��С
B.����AgCl��Һ�뱥��Ag2CrO4��Һ��ȣ�ǰ�ߵ�c��Ag+����
C.����0.0008 molL��1��K2CrO4��Һ�м�������0.002 molL��1��AgNO3��Һ����CrO42����ȫ��������ʾ��������ȫc��CrO42������10��5 molL��1��
D.����0.001 molL��1 AgNO3��Һ����Ũ�Ⱦ�Ϊ0.001 molL��1��KCl��K2CrO4�����Һ�У����Ȳ���AgCl����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com