
【题目】如下图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液.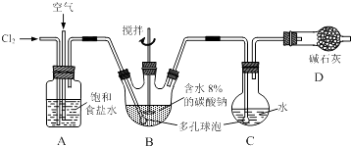
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8℃,42℃以上分解为Cl2和O2 .
(1)①实验中控制氯气与空气体积比的方法是 .
②为使反应充分进行,实验中采取的措施有 .
(2)①装置B中产生Cl2O的化学方程式为: .
②若B无冷却装置,则进入C中的Cl2O会大量减少.其原因是 .
(3)装置C中采用棕色圆底烧瓶是因为 .
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl﹣ . 测定C中次氯酸溶液的物质的量浓度的实验方案为:用取20.00mL次氯酸溶液, . (可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液.除常用仪器外须使用的仪器有:电子天平,真空干燥箱)
【答案】
(1)通过观察A中产生气泡的速率调节流速;搅拌、使用多孔球泡
(2)2Cl2+Na2CO3=Cl2O+2NaCl+CO2;该反应放热,温度升高Cl2O会分解
(3)HClO见光易分解
(4)酸式滴定管;加入足量的H2O2溶液,再加入足量的硝酸银溶液,过滤,洗涤,在真空干燥箱中干燥,用电子天平称量沉淀质量
【解析】解:(1)①氯气和空气按照体积比约1:3混合通入潮湿碳酸钠中,控制氯气与空气体积比的方法可以通过观察A中产生气泡的比例来调节气体的流速,
所以答案是:通过观察A中产生气泡的速率调节流速;
②为了氯气和原溶液充分接触完全反应,可以通过增加气体与溶液的接触面积、并用搅拌棒搅拌等方法,
所以答案是:搅拌、使用多孔球泡;(2)①装置B中,氯气本身既作为氧化剂又作还原剂,本身被氧化到+1价的Cl2O,被还原到﹣1价的氯化钠,故化学方程式为2Cl2+Na2CO3═Cl2O+2NaCl+CO2 ,
所以答案是:2Cl2+Na2CO3═Cl2O+2NaCl+CO2;(4)由于该反应为放热反应,温度升高Cl2O会分解,故进入C中的Cl2O会大量减少,
所以答案是:该反应放热,温度升高Cl2O会分解;(3)装置C中使用棕色平底烧瓶,目的是可以避光,防止反应生成的HClO见光分解,
所以答案是:HClO见光易分解;(4)选择使用酸式滴定管量取20.00mL的次氯酸溶液,具体实验操作是,向20.00mL的次氯酸溶液里加入足量的H2O2溶液,再加入足量的硝酸银溶液,过滤、洗涤,在真空干燥箱中干燥沉淀,用电子天平称量沉淀的质量,
所以答案是:酸式滴定管; 加入足量的H2O2溶液,再加入足量的硝酸银溶液,过滤,洗涤,在真空干燥箱中干燥,用电子天平称量沉淀质量.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列溶液中Cl﹣的物质的量浓度最大的是( )
A. 1000mL2.5molL﹣1 NaCl溶液B. 200mL2molL﹣1MgCl2溶液
C. 250mL1molL﹣1AlCl3溶液D. 300mL5molL﹣1FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能大量共存的离子组是( )
A. Na+、NO3-、K+、Fe2+ B. Cu2+、Na+、SO42-、K+
C. K+、I-、NO3-、Ca2+ D. OH-、NO3-、Na+、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为防止有机物挥发,可加一层水保存,即水封。下列有机物中,既能用水封法保存,又能发生水解和消去反应的是
A.乙醇B.溴乙烷C.乙酸乙酯D.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列叙述中正确的是:( )
A. 浓硫酸具有吸水性,因而能使蔗糖炭化
B. 常温下浓硫酸、浓硝酸都可迅速与铜片反应放出气体
C. NH3的催化氧化是工业上制硝酸的重要反应
D. 浓硫酸、浓硝酸露置于空气中,溶液质量均增重
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X位于第四周期,其基态原子有4个未成对电子.Y原子最外层电子数是其内层电子总数的3倍,元素Z基态原子的3p轨道上有4个电子.
(1)Y与Z可形成多种化合物. ①元素Y与Z中电负性较大的是(用元素符号描述).
②离子ZY32﹣的空间构型为(用文字描述).
③写出一种与ZY2互为等电子体的氧化物分子的化学式 .
(2)Y的氢化物(H2Y)在乙醇中的溶解度大于H2Z,其原因是 .
(3)含X2+的溶液与KCN、氨水反应可得到化合物K3[X(CN)5(NH3)]. ①基态X2+的电子排布式是
②1mol配合物K3[X(CN)5(NH3)]中含σ键的数目为 .
(4)下图为X与Z所形成的一种化合物的基本结构单元,推测该化合物的化学式: . 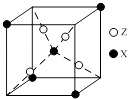
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HIO4主要以H5IO6形式存在,H5IO6是白色晶体,易溶于水,具有很强的氧化性,在强酸溶液中能氧化Mn2+。
(1)请完成并配平下列离子反应。
__________Mn2++________H5IO6![]() __________
__________![]() +________
+________![]() +________H++________
+________H++________
(2)根据以上离子方程式判断H5IO6是________电离物质(填“易”或“难”)。
(3)上述反应,被氧化的元素是________(填元素符号),当1 mol Mn2+参加反应时,转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等体积、等物质的量浓度的醋酸与氢氧化钠溶液混合后,溶液呈(填“酸性”、“中性”或“碱性”.下同.)溶液中C(Na+)C(CH3COO)(填“大于”、“小于”或“等于”.下同.)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:银锌电池放电时总反应为Zn+Ag2O+H2O═Zn(OH)2+2Ag,用银锌电池作电源,在非水体系中完成钢制品上镀铝的原理如图所示,下列说法正确的是( ) 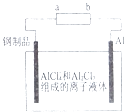
A.a电极的电极反应式为Ag2O+H2O+2e﹣=2Ag+2OH﹣
B.银锌电池的电解质溶液可用稀硫酸
C.银锌电池放电时,负极附近溶液的pH增大
D.Al电极上发生的电极反应式为Al+7AlCl4﹣﹣3e﹣=4Al2Cl4﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com