
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A. 含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B. 在常温常压下,11.2L Cl2含有的分子数为0.5NA
C. 25℃,101KPa,64gSO2中含有的原子数为3NA
D. 标准状况下,11.2LH2O含有的分子数为0.5NA
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】锰的化合物是优良的催化剂,可用于干电池原料生产等.
(1)锌锰干电池的反应为2MnO2+Zn+2NH4Cl=2MnO(OH)+Zn(NH3)2Cl2 , MnO(OH)中锰元素的化合价为 .
(2)向废电池还原后的废液(含有Mn2+、Fe2+、Zn2+等)中逐滴滴加Na2S溶液,最先生成的沉淀为(填化学式).[已知Ksp(MnS)=1.4×10﹣15 , Ksp(ZnS)=2.9×10﹣25 , Ksp(FeS)=6.0×10﹣18]
(3)Mn2+催化H2O2分解:2H2O2(l)=2H2O(l)+O2(g)△H1 , 其反应机理如图:
①已知反应Ⅱ为MnO2(s)+H2O2(1)+2H+ ( aq)=Mn2+ (aq)+O2(g)+2H2O(1)△H2 . 写出反应 I的热化学方程式(焓变用△H1和△H2表示): .
②某温度时,向10mL0.4mol/L H2O2液中滴入1滴MnSO4发生分解:2H2O2=2H2O+O2 , 测得不同时刻生成O2的体积(已折算为标准状况下的体积)如表:
t/min | 0 | 2 | 4 | 6 |
V(O2)mL | 0 | 9.9 | 17.2 | 22.4 |
0~2min时反应速率比2~4min时的快,其原因是 , 0~6min的平均反应速率v(H2O2)=(忽略溶液体积的变化).
(4)锰基催化剂是合成甲醇、二甲醚的催化剂.已知:
反应 | 平衡常数KP | |
773K | 873K | |
Ⅰ.CO2(g)+4H2(g)CH4(g)+2H2(g) | 19.4 | 0.803 |
Ⅱ.CO2(g)+3H2(g)CH3OH(g)+H2O(g) | 6.07×10-9 | 3.65×10-9 |
①反应I的正反应是(填“放热”或“吸热”)反应.
②反应Ⅱ的平衡常数表达式为 . 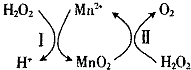
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列关于电解质溶液的说法正确的是( )
A.将pH=4 CH3COOH溶液加水稀释10倍,溶液中各种离子浓度均减小
B.用 CH3COOH溶液滴定等物质的量浓度的NaOH溶液至中性,V(CH3COOH溶液)<V(NaOH溶液)
C.向0.2 mol?L﹣1的盐酸溶液中加入等体积0.1 mol?L﹣1NH3?H2O溶液:c(Cl﹣)+c(OH﹣)═c(H+)+c(NH3?H2O)
D.在含0.1mol NaHSO4溶液中:c(H+)═c(SO ![]() )+c(OH﹣)
)+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在酸性条件下发生的反应为AsO43﹣+2I﹣+2H+═AsO33﹣+I2+H2O,在碱性条件下发 生的反应为AsO33﹣+I2+2OH﹣═AsO43﹣+H2O+2I﹣ . 设计如图装置(C1、C2均为石墨电极),分别进行下述操作: Ⅰ.向B烧杯中逐滴加入浓盐酸,发现电流表指针发生偏转
Ⅱ.若改向B烧杯中逐滴加入40% NaOH溶液 发现电流表指针偏转方向与Ⅰ相反. 试回答下列问题:
(1)两次操作过程中指针偏转方向为什么相反?试用化学平衡移动原理解释 .
(2)操作Ⅰ过程中C1棒为极,发生的电极反应为 .
(3)操作Ⅱ过程中C2棒为极,发生的电极反应为 . 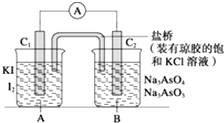
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液混合后,不会发生离子反应的是( )
A. 硝酸钡溶液和硫酸钠溶液B. 醋酸钠溶液和稀硫酸
C. 碳酸钾溶液和硫酸氢钠溶液D. 硝酸钾溶液和氯化铜溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的量的关系曲线,下列判断错误的是
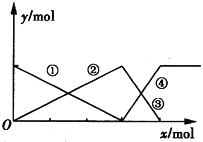
A. ①线表示Al3+的物质的量的变化 B. x表示AlCl3的物质的量
C. ②③线均表示Al(OH)3的物质的量的变化 D. ④线表示[Al(OH)4]-的物质的量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有铁和铜的混合物17.5g,其中铁的质量分数为32%,与足量盐酸反应。
(1)参加反应的铁的物质的量是多少;__________
(2)生成标准状况下的氢气的体积__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A.反应物的总能量高于生成物的总能量时,该反应常温下即可发生
B.氢气燃烧热为285.8kJmol﹣1 , 则有H2(g)+1/2O2(g)=H2O(g)△H=﹣285.8kJmol﹣1
C.将1molBa(OH)2的稀溶液与稀盐酸完全中和,放出114.6kJ的热量,热化学方程式为:OH﹣(aq)+H+(aq)=H2O(l)△H=﹣114.6kJmol﹣1
D.2SO2(g)+O2(g)2SO3(g);△H=﹣QkJmol﹣1(Q>0),则将2molSO2(g)和足量O2置于一密闭容器中,充分反应后放出的热量一定小于QkJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院官方微信中科院之于2017年3月9日发表《一个“网红”的转化-灰霾专题》,提出灰霾细颗粒物的成因,部分分析如下图所示。
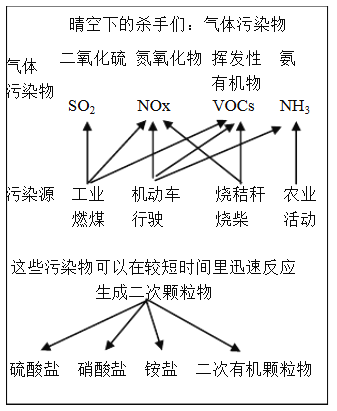
(1)根据上图信息可以看出,下列哪种污染源不产生NOx_________.
A.工业燃煤 B.机动车尾气 C.烧秸秆 D.农业活动
(2)若某地空气潮湿,且空气含有的大气污染物主要是SO2、NH3,根据上图中所举的“SO2![]() SO32-
SO32-![]() 盐
盐![]() SO42-
SO42-![]() 盐”的流程,请写出该地形成二次颗粒物硫酸盐的化学反应方程式:_____________。
盐”的流程,请写出该地形成二次颗粒物硫酸盐的化学反应方程式:_____________。
(3)当前频繁出现的雾霾天气与汽车尾气的排放有一定的关系,为了减少污染,可尝试使用汽车尾气净化装置,其原理如图所示。
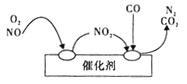
写出净化过程中的总化学方程式:________
(4)将装有amLNO和NO2混合气体的集气瓶倒立在水槽中,然后鼓入一定量O2,最终集气瓶里面剩余气体体积为bmL,则集气瓶内所得HNO3的物质的量浓度为______mol/L(不考虑集气瓶内硝酸扩散到水槽中,设气体摩尔体积为Vm)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com