
����Ŀ����֪�������������·����ķ�ӦΪAsO43��+2I��+2H+�TAsO33��+I2+H2O���ڼ��������·� ���ķ�ӦΪAsO33��+I2+2OH���TAsO43��+H2O+2I�� �� �����ͼװ�ã�C1��C2��Ϊʯī�缫�����ֱ�������������� ����B�ձ�����μ���Ũ���ᣬ���ֵ�����ָ�뷢��ƫת
��������B�ձ�����μ���40% NaOH��Һ ���ֵ�����ָ��ƫת��������෴�� �Իش��������⣺
��1�����β���������ָ��ƫת����Ϊʲô�෴�����û�ѧƽ���ƶ�ԭ������ ��
��2�������������C1��Ϊ���������ĵ缫��ӦΪ ��
��3�������������C2��Ϊ���������ĵ缫��ӦΪ �� 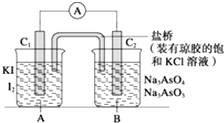
���𰸡�
��1����������ᣬc��H+������AsO43���õ��ӣ�I�� ʧ���ӣ�����C1�Ǹ�����C2��������������Ӽc��OH��������AsO33��ʧ���ӣ�I2�õ��ӣ���ʱ��C1��������C2�Ǹ������ʷ����� ͬ����ķ�Ӧ������ת�Ʒ���ͬ����������ָ��ƫת����ͬ
��2������2I����2e��=I2
��3������AsO33��+2OH����2e��=AsO43��+H2O
���������⣺��ͼ��֪����װ��Ϊԭ��أ�����AsO43��+2I��+2H+=AsO33��+I2+H2O��C1��Ϊ�������缫��Ӧ����2I����2e��=I2������AsO33��+I2+2OH��=AsO43��+2I��+H2O��C2��Ϊ�����������ɸ���������������1�������β������̾����γ�ԭ��أ����ǰѻ�ѧ��ת��Ϊ���ܣ��γɵ���ָ��ƫת�����1��C1�Ǹ�����C2������������2��C1��������C2�Ǹ����������ɸ���������������ָ��ƫת����ͬ�� ���Դ��ǣ���������ᣬc��H+������AsO43���õ��ӣ�I�� ʧ���ӣ�����C1�Ǹ�����C2��������������Ӽc��OH��������AsO33��ʧ���ӣ�I2�õ��ӣ���ʱ��C1��������C2�Ǹ������ʷ����� ͬ����ķ�Ӧ������ת�Ʒ���ͬ����������ָ��ƫת����ͬ����2��C1��Ϊ�������缫��Ӧ����2I����2e��=I2 �� ���Դ��ǣ�����2I����2e��=I2�� ��3��C2��Ϊ�������缫��ӦΪAsO33��+2OH����2e��=AsO43��+H2O�����Դ��ǣ�����AsO33��+2OH����2e��=AsO43��+H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L���ܱ������г���7.6mol NO��3.8mol O2 �� �������·�Ӧ�� ��2NO��g��+O2��g��2NO2��g��
��2NO2��g��N2O4��g��
���NO2��N2O4��Ũ�ȱ仯��ͼ��ʾ��0��10minά�������¶�ΪT1�棬10min�����߲�ά���������¶�ΪT2�森����˵����ȷ���ǣ� ��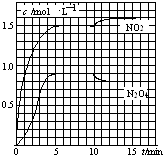
A.ǰ5min��Ӧ��ƽ������v��N2O4��=0.36mol��Lmin����1
B.T1��ʱ��Ӧ�ڵĻ�ѧƽ�ⳣ��K=0.6
C.��Ӧ�١��ھ�Ϊ���ȷ�Ӧ
D.����ʼʱ��������г���3.6mol NO2��2.0mol N2O4 �� T1��ﵽƽ��ʱ��N2O4��ת����Ϊ10%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ���������Ŀ��
��1��������һ����Ҫ�ĺ����ᣮʵ������Ũ�������Ҷ��ᣨH2C2O4�����廨�ȣ��ɻ��CO��CO2�Ļ�����壬�ٽ���������һ��ͨ������һ���Լ������ƣ����ɵô��������CO��
��2����ˮ���ܶ�����ˮ���п��ٵ�ɱ��������ҩ��ͨ�����������㣮�������Ⱦ� Cl2Na��NCO��3����ˮ��Ӧ�����ɴ�������ɱ���������ã������Ӻ��ڲ���������ƣ�Na2SO3���ܳ����ɽ�ˮ�е����ȣ�������ȣ���ȥ�����Ⱦ�����Ԫ�صĻ��ϼ�Ϊ����ˮ�������Ƹ����������ȵ�600��㿪ʼ�ֽ⣬�ֽ���������ƺ���һ���壮��д����ˮ�����������ȷֽ�ķ�Ӧ����ʽ��
��3��ij����M��һ����������������Ϊȷ���仯ѧʽ��ijС����Ʋ����������ʵ�飺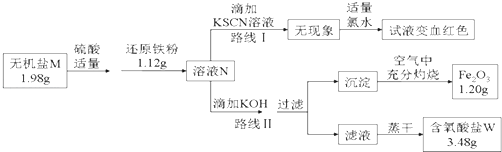
��֪��
������M���ɼ����Ӻ�һ�ֺ��������ɣ�������е�ԭ�Ӹ�����Ϊ2��1��4��
����ͼ�У���1.98g����������ˮ���μ�����ϡ������ټ���1.12g��ԭ���ۣ�ǡ����ȫ��Ӧ�û����ҺN��
�۸�С��ͬѧ����ҺN��Ϊ���ȷݣ��ֱ�·�ߢ�·�ߢ����ʵ�飮
����·�ߢ��У���������ҺN�еμ�����KOH��Ԫ��X�պó�����ȫ�����˺����ڿ����г�����յô�����Fe2O3��ĩ1.20g���ٽ���Һ��һ�����������ɣ�ֻ�õ�3.48g�����IJ����ᾧˮ������W��
�밴Ҫ��ش��������⣺
����·�ߢ�������֪����ҺN�к��е�����������
����ʵ������ͼ���Ƶã���������W�Ļ�ѧʽ������·�ߢ��֪��1.98g����M��������Ԫ�ص�����Ϊg��
������M��1.12g��ԭ����ǡ����ȫ��Ӧ������ҺN�Ļ�ѧ��Ӧ����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ע���ķ����������и���������в���ȷ���ǣ� ��
A. ������������Һ������ B. ʳ���е�ɳ�����ܽ���ˣ�
C. �������������ˮ�����ˣ� D. �����ͺ�ˮ����Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͭ�Ǻϳ��������������в��ϩ�����������ͭ����Ҫǰ����֮һ������������һ��ʵ���Һϳ�·�ߣ� 
�Ʊ��������װ��ʾ��ͼ��ͼ�����Ⱥͼг�װ�õ��ԣ���
��֪����������۵�Ϊ76.5�棬������ˮ�������Ҵ���
�ش��������⣺
��1����250mL����ƿa�м���70mL 70%���ᣬ���ƴ�����ʱ����������ˮ��Ũ������Ⱥ�˳������
��2����a�е���Һ������100�棬�����μ�40g�����浽������Һ�У�Ȼ��������130�������Ӧ����װ���У�����b��������������c�������� �� �������� �� ��Ӧ�������������ˮ���ٷ�����������Ʒ��������ˮ��Ŀ���� �� ���������п����ڷ��뱽�����Ʒ���������ţ� A����Һ©�� B��©�� C���ձ� D��ֱ�������� E��������
��3���ᴿ������ķ����� �� ���յõ�44g��Ʒ��������IJ�������
��4����CuCl22H2O��NaOH��Һ�Ʊ�����Cu��OH��2�����������������ˮϴ�ӳ������жϳ���ϴ�ɾ���ʵ���������������
��5������������뵽�Ҵ���ˮ�Ļ���ܼ��У�����ܽ����Cu��OH��2����30min�����ˣ���Һ����һ��ʱ�䣬����������ͭ���壬����ܼ����Ҵ��������� �� 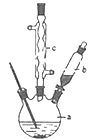
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�������Һ�д���������ǣ� ��
A. H+��NO3-��Cl-��Fe2+B. Na+��Mg2+��SO42-��OH-
C. Cu2+��Ba2+��NO3-��CO32-D. K+��Na+��OH-��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������������ȷ���� �� ��
A. ����NA����ԭ�ӵĺ����ڱ�״���µ����ԼΪ11.2L
B. �ڳ��³�ѹ�£�11.2L Cl2���еķ�����Ϊ0.5NA
C. 25����101KPa��64gSO2�к��е�ԭ����Ϊ3NA
D. ��״���£�11.2LH2O���еķ�����Ϊ0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����طŵ�ʱ����ԭ��ص����ã��ڳ��ʱ����ص����ã���ʽ�ǰ��������طֱ��ڳ�硢�ŵ�ʱ�ķ�Ӧ��Fe+NiO2+2H2O ![]() Fe��OH��2+Ni��OH��2 �� �����йذ�������صĸ����ƶ��д�����ǣ� ��
Fe��OH��2+Ni��OH��2 �� �����йذ�������صĸ����ƶ��д�����ǣ� ��
A.�ŵ�ʱ����������NiO2������
B.���ʱ�����ϵĵ缫��ӦΪ��Fe��OH��2+2e���TFe+2OH��
C.�ŵ�ʱ���������Һ�е��������������������ƶ�
D.���ص������缫��������ڼ�����Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ϊ����������ͭ��Ӧ��������Ⱦ�����Թ�ҵ�ϳ��ð�����ԭ����ͭ��ȡͭ��������ѧ��ѧ��ȤС��Ϊ��ģ��÷�Ӧ��ͬʱ���ͭ�����ԭ�������IJⶨ�����������ʾ��װ��ͼ��������ʵ��:
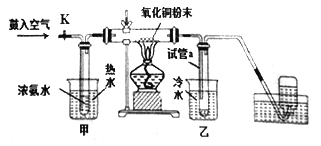
�ٶ����ⶨͭ�����ԭ��������ʵ������У�����ͭ��ַ�Ӧ�����������������
A. �ر�K����������ʵ�飬����Թ������ռ�����Һ������������ͭ�������������ͭ�����ԭ������
B. �ر�K����������ʵ�飬�������ͭ�ķ�ĩ�ķ�Ӧǰ������������ռ���ƿ���ռ������������(��״����)�������ͭ�����ԭ������
C. ֱ�Ͳ������з����ķ�ӦΪ��3CuO+2NH3![]() N2��+3Cu+3H2O
N2��+3Cu+3H2O
D. ����K�����������ֱ�Ͳ�����������ͭ��ĩ�ύ����ֺ�ɫ���ɫ����ɫ���ɫ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com