
【题目】根据所学知识完成下面题目:
(1)硫酸是一种重要的含氧酸.实验室用浓硫酸与乙二酸(H2C2O4)晶体花热,可获得CO与CO2的混合气体,再将混合气体进一步通过(填一种试剂的名称)即可得纯净干燥的CO.
(2)净水丸能对饮用水进行快速的杀菌消毒,药丸通常分内外两层.外层的优氯净 Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去;优氯净中氯元素的化合价为;无水亚硫酸钠隔绝空气加热到600℃便开始分解,分解产物是硫化钠和另一固体.请写出无水亚硫酸钠受热分解的反应方程式;
(3)某无机盐M是一种优良的氧化剂,为确定其化学式,某小组设计并完成了如下实验: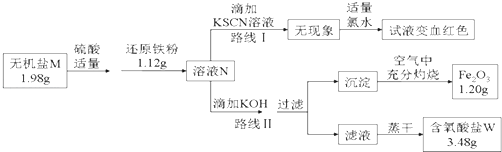
已知:
①无机盐M仅由钾离子和一种含氧酸根组成,其分子中的原子个数比为2:1:4;
②如图中,将1.98g该无机盐溶于水,滴加适量稀硫酸后,再加入1.12g还原铁粉,恰好完全反应得混合溶液N.
③该小组同学将溶液N分为二等份,分别按路线Ⅰ、路线Ⅱ进行实验.
④在路线Ⅱ中,首先向溶液N中滴加适量KOH至元素X刚好沉淀完全,过滤后将沉淀在空气中充分灼烧得纯净的Fe2O3粉末1.20g;再将滤液在一定条件下蒸干,只得到3.48g纯净的不含结晶水的正盐W.
请按要求回答下列问题:
①由路线Ⅰ的现象可知,溶液N中含有的阳离子是;
②由实验流程图可推得,含氧酸盐W的化学式是;由路线Ⅱ可知,1.98g无机盐M中所含钾元素的质量为g;
③无机盐M与1.12g还原铁粉恰好完全反应生成溶液N的化学反应方程为 .
【答案】
(1)碱石灰(CaO或NaOH固体)
(2)+1;取适量固体于试管,加水溶解,滴加过量盐酸至无气体放出,再滴加BaCl2 , 有白色沉淀生成证明试样已经变质
(3)Fe2+;K2SO4;0.78;2Fe+K2FeO4+4H2SO4═3FeSO4+K2SO4+4H2O
【解析】解:(1)硫酸是一种重要的含氧酸,实验室用浓硫酸与乙二酸(H2C2O4)晶体共热,可获得CO与CO2的混合气体,再将混合气进一步通过要得到纯净的CO气体,需要除去混合气体中二氧化碳和水,所以应该用碱石灰干燥,所以答案是:碱石灰(CaO或NaOH固体);(2)优氯净Cl2Na(NCO)3中,钠离子的化合价为+1价,N为﹣3价、O为﹣2价、C为+4价,设Cl元素的化合价为x,则:2x+(+1)+3[(﹣3)+(+4)+(﹣2)]=0,解得:x=+1;亚硫酸钠溶液在空气中易变质,则溶液中会存在硫酸根离子,所以判断亚硫酸钠溶液是否变质的方法为:取适量固体于试管,加水溶解,滴加过量盐酸至无气体放出,再滴加BaCl2 , 有白色沉淀生成证明试样已经变质,
所以答案是:+1;取适量固体于试管,加水溶解,滴加过量盐酸至无气体放出,再滴加BaCl2 , 有白色沉淀生成证明试样已经变质;(3)①根据路线Ⅰ可知,N溶液中一定含有亚铁离子,
所以答案是:Fe2+;②1.2g氧化铁的物质的量为: ![]() =0.0075mol,则溶液中含有铁元素的物质的量为:0.0075mol×2×2=0.03mol,质量为:56g/mol×0.03mol=1.68g>1.12g,所以无机盐M中一定含有Fe元素,无机盐M分子中的原子个数比为2:1:4,则M的化学式为:K2FeO4 , 根据流程可知,K2FeO4与稀硫酸、还原铁粉反应生成硫酸亚铁和硫酸钾,根据质量守恒可知W为硫酸钾;1.98gK2FeO4的物质的量为
=0.0075mol,则溶液中含有铁元素的物质的量为:0.0075mol×2×2=0.03mol,质量为:56g/mol×0.03mol=1.68g>1.12g,所以无机盐M中一定含有Fe元素,无机盐M分子中的原子个数比为2:1:4,则M的化学式为:K2FeO4 , 根据流程可知,K2FeO4与稀硫酸、还原铁粉反应生成硫酸亚铁和硫酸钾,根据质量守恒可知W为硫酸钾;1.98gK2FeO4的物质的量为 ![]() =0.01mol,0.01molK2FeO4中含有0.02mol钾离子,含有钾离子的质量为:39g/mol×0.02mol=0.78g,所以答案是:K2SO4 ;0.78;③无机盐M与还原铁粉反应生成硫酸亚铁、硫酸钾和水,反应的化学方程式为:2Fe+K2FeO4+4H2SO4═3FeSO4+K2SO4+4H2O,所以答案是:2Fe+K2FeO4+4H2SO4═3FeSO4+K2SO4+4H2O.
=0.01mol,0.01molK2FeO4中含有0.02mol钾离子,含有钾离子的质量为:39g/mol×0.02mol=0.78g,所以答案是:K2SO4 ;0.78;③无机盐M与还原铁粉反应生成硫酸亚铁、硫酸钾和水,反应的化学方程式为:2Fe+K2FeO4+4H2SO4═3FeSO4+K2SO4+4H2O,所以答案是:2Fe+K2FeO4+4H2SO4═3FeSO4+K2SO4+4H2O.


科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,将X溶液逐滴加入固体Y中,装置B的试管中的现象不正确的是( )
选项 | X溶液 | 固体Y | Z溶液 | 现象 |
|
A | 稀硫酸 | 亚硫酸氢钠 | 品红试剂 | 品红褪色 | |
B | 浓氨水 | CaO | 紫色石蕊试液 | 溶液变红 | |
C | 盐酸 | 石灰石 | 硅酸钠溶液 | 出现白色沉淀 | |
D | 双氧水 | MnO2 | 氢硫酸溶液 | 产生浑浊 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰的化合物是优良的催化剂,可用于干电池原料生产等.
(1)锌锰干电池的反应为2MnO2+Zn+2NH4Cl=2MnO(OH)+Zn(NH3)2Cl2 , MnO(OH)中锰元素的化合价为 .
(2)向废电池还原后的废液(含有Mn2+、Fe2+、Zn2+等)中逐滴滴加Na2S溶液,最先生成的沉淀为(填化学式).[已知Ksp(MnS)=1.4×10﹣15 , Ksp(ZnS)=2.9×10﹣25 , Ksp(FeS)=6.0×10﹣18]
(3)Mn2+催化H2O2分解:2H2O2(l)=2H2O(l)+O2(g)△H1 , 其反应机理如图:
①已知反应Ⅱ为MnO2(s)+H2O2(1)+2H+ ( aq)=Mn2+ (aq)+O2(g)+2H2O(1)△H2 . 写出反应 I的热化学方程式(焓变用△H1和△H2表示): .
②某温度时,向10mL0.4mol/L H2O2液中滴入1滴MnSO4发生分解:2H2O2=2H2O+O2 , 测得不同时刻生成O2的体积(已折算为标准状况下的体积)如表:
t/min | 0 | 2 | 4 | 6 |
V(O2)mL | 0 | 9.9 | 17.2 | 22.4 |
0~2min时反应速率比2~4min时的快,其原因是 , 0~6min的平均反应速率v(H2O2)=(忽略溶液体积的变化).
(4)锰基催化剂是合成甲醇、二甲醚的催化剂.已知:
反应 | 平衡常数KP | |
773K | 873K | |
Ⅰ.CO2(g)+4H2(g)CH4(g)+2H2(g) | 19.4 | 0.803 |
Ⅱ.CO2(g)+3H2(g)CH3OH(g)+H2O(g) | 6.07×10-9 | 3.65×10-9 |
①反应I的正反应是(填“放热”或“吸热”)反应.
②反应Ⅱ的平衡常数表达式为 . 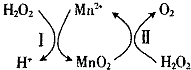
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化物的叙述正确的是( )
A. 金属氧化物都是碱性氧化物
B. 酸性氧化物均可与碱反应
C. 酸性氧化物都是非金属氧化物
D. 氧化铜是碱性氧化物,可与水反应生成Cu(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体.合成肉桂酸甲酯的工业流程如图所示: 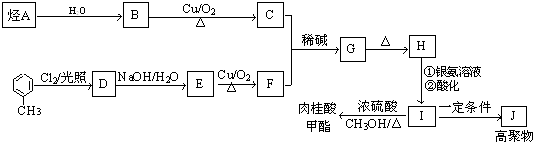
已知:
I.醛与醛能发生反应,原理如下:![]() +CH3CHO
+CH3CHO ![]()
![]()
![]() RCH=CHCHO
RCH=CHCHO
Ⅱ.烃A在标准状况下的密度为1.25g/L.
请回答:
(1)化合物H中的官能团为;
(2)肉桂酸甲酯的结构简式为;J的结构简式为;
(3)G→H的反应类型为;
(4)写出反应B→C的化学方程式;H→I的反应(填“能”或“不能”)改用酸性高锰酸钾溶液,简述理由: .
(5)符合下列条件的I的同分异构体共有5种.写出另两种同分异构体的结构简式: A.能发生水解反应 B.与银氨溶液作用出现光亮的银镜 C.能与溴发生加成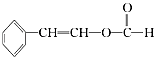 、
、 ![]() 、、 .
、、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列关于电解质溶液的说法正确的是( )
A.将pH=4 CH3COOH溶液加水稀释10倍,溶液中各种离子浓度均减小
B.用 CH3COOH溶液滴定等物质的量浓度的NaOH溶液至中性,V(CH3COOH溶液)<V(NaOH溶液)
C.向0.2 mol?L﹣1的盐酸溶液中加入等体积0.1 mol?L﹣1NH3?H2O溶液:c(Cl﹣)+c(OH﹣)═c(H+)+c(NH3?H2O)
D.在含0.1mol NaHSO4溶液中:c(H+)═c(SO ![]() )+c(OH﹣)
)+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在酸性条件下发生的反应为AsO43﹣+2I﹣+2H+═AsO33﹣+I2+H2O,在碱性条件下发 生的反应为AsO33﹣+I2+2OH﹣═AsO43﹣+H2O+2I﹣ . 设计如图装置(C1、C2均为石墨电极),分别进行下述操作: Ⅰ.向B烧杯中逐滴加入浓盐酸,发现电流表指针发生偏转
Ⅱ.若改向B烧杯中逐滴加入40% NaOH溶液 发现电流表指针偏转方向与Ⅰ相反. 试回答下列问题:
(1)两次操作过程中指针偏转方向为什么相反?试用化学平衡移动原理解释 .
(2)操作Ⅰ过程中C1棒为极,发生的电极反应为 .
(3)操作Ⅱ过程中C2棒为极,发生的电极反应为 . 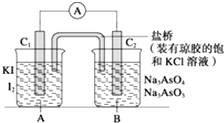
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A.反应物的总能量高于生成物的总能量时,该反应常温下即可发生
B.氢气燃烧热为285.8kJmol﹣1 , 则有H2(g)+1/2O2(g)=H2O(g)△H=﹣285.8kJmol﹣1
C.将1molBa(OH)2的稀溶液与稀盐酸完全中和,放出114.6kJ的热量,热化学方程式为:OH﹣(aq)+H+(aq)=H2O(l)△H=﹣114.6kJmol﹣1
D.2SO2(g)+O2(g)2SO3(g);△H=﹣QkJmol﹣1(Q>0),则将2molSO2(g)和足量O2置于一密闭容器中,充分反应后放出的热量一定小于QkJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com