
【题目】某市售照明材料LED晶片是一种发光二极管。材质组成为:GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、GaInN(氮化镓铟)等。请回答下列问题:
(1)砷基态原子的核外电子排布式为______________________。
(2)上述非金属元素氢化物的沸点从高到低的顺序为___________。
(3)下列说法正确的是___________
a.电负性:As<Ga b.SiC与GaAs互为等电子体 c.第一电离能:As>Se>Ga
(4)如图所示为GaAs的晶胞结构,晶体熔点为1237℃。
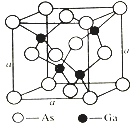
①晶胞中砷与镓原子间的化学键类型有___________。
②一个镓原子周围所有距离最近且相等的砷原子形成的空间构型是___________。
③一个晶胞的组成为___________。
④已知晶胞棱长a=5.64×10-10m,则该晶胞密度为ρ=___________。
【答案】 1s22s22p63s23p63d104s24p3 NH3>AsH3>PH3 bc 共价键(或极性键)、配位键 正四面体 Ga4As4 5.37g·cm-3
【解析】(1). 砷是33号元素,基态原子的核外电子排布式为1s22s22p63s23p63d104s24p3,故答案为:1s22s22p63s23p63d104s24p3;
(2). 因氨气分子之间存在氢键,所以氨气在三种氢化物中沸点最高,AsH3和PH3的组成和结构相似,相对分子质量越大,分子间作用力越大,氢化物的沸点越高,所以氢化物的沸点从高到低的顺序为:NH3>AsH3>PH3,故答案为:NH3>AsH3>PH3;
(3). a. 同一周期的元素,随原子序数增大,元素的电负性增大,所以电负性As>Ga,故a错误;b. SiC与GaAs中原子总数相等,价电子数相同,所以互为等电子体,故b正确;c. 同一周期的元素,随原子序数增大,元素的第一电离能呈增大趋势,As元素的价电子排布式为4s24p3,是一种半充满的稳定结构,第一电离能较大,所以第一电离能:As>Se>Ga,故c正确;答案为:bc;
(4). ①. 由GaAs的晶胞结构和晶体熔点可知,晶胞中砷与镓原子之间含有共价键,由于Ga原子最外层只有3个电子,而每个Ga原子与 4个As原子成键,因此其中一个键是配位键,故答案为:共价键(或极性键)、配位键;
②. 由晶胞结构可知,每个Ga原子与 4个As原子成键,一个Ga原子周围所有距离最近且相等的4个As原子构成正四面体,故答案为:正四面体;
③. Ga原子位于体内,个数为4,As原子位于顶点和面心,个数为8×![]() +6×
+6×![]() =4,所以一个晶胞的组成为Ga4As4,故答案为:Ga4As4;
=4,所以一个晶胞的组成为Ga4As4,故答案为:Ga4As4;
④. 由上述分析可知,一个晶胞的组成为Ga4As4,则该晶胞的密度为ρ=![]() =5.37g·cm-3,故答案为:5.37g·cm-3。
=5.37g·cm-3,故答案为:5.37g·cm-3。


科目:高中化学 来源: 题型:
【题目】能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是( )
A. 向水中投入一小块金属钠 . B. 将水加热煮沸.
C. 向水中通入二氧化碳气体. D. 向水中加食盐晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关乙烯化学性质的说法,错误的是( )
A.乙烯能使酸性高锰酸钾溶液褪色,是由于乙烯发生了氧化反应
B.乙烯可在氧气中燃烧,该反应属于乙烯的氧化反应
C.将乙烯通入溴水中,反应后得到均一、透明的液体
D.乙烯能使溴的四氯化碳溶液褪色,该反应属于加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)24.8 g Na2R含有Na+ 0.8 mol则R的摩尔质量为_________________。
(2)质量都为ag的镁和铝,物质的量之比为___________;将它们分别放入适量的盐酸溶液中恰好完全反应,则消耗的HCl的物质的量之比为___________。
(3)在标准状况下,CO和CO2混合气体的质量为36 g,体积为22.4 L,则其中CO2所占的体积为_________,CO所占的质量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐除含NaCl外,还含Mg2+、Ca2+、SO42-以及泥沙等杂质。以下是制备精盐的各步操作流程:
(1)过滤和蒸发操作中所使用的共同玻璃仪器是______,他们的作用分别是________、_______。
(2)过滤操作中要点可概括为“一贴、二低、三靠”,其中“二低”的含义是_______;_________。
(3)蒸发食盐水时,何时停止加热?__________________________。
(4)第②步操作的目的是除去粗盐中的__________(填化学式), 所涉及的化学方程式是________,判断BaCl2已过量的方法是__________。
(5)第③步操作中,除杂试剂不能用KOH的理由是______。
(6)第④步操作中加入的除杂试剂是__________(填化学式)。
(7)写出第⑥步操作中涉及的化学方程式:__________。
(8)实验室进行NaCl溶液蒸发结晶时,一般有以下操作过程,其正确的操作顺序为_______
①固定铁圈位置;②放置酒精灯;③放上石棉网;④放上蒸发皿;⑤加热搅拌;⑥停止加热,余热蒸干
A.①②③④⑤⑥ B.②①③④⑤⑥ C.②①④⑤⑥ D.②①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积为V L、密度为ρ g·cm-3的某溶液中,含有摩尔质量为M的溶质m g。若此溶液中溶质的物质的量浓度为c mol·L-1,溶质的质量分数为w,则下列各表示式中正确的是( )
A. c=m/MV B. m=Vρw C. w=cM/ρ D. ρ=cM/1000w%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、有4种化合物W(通常状况下是气态)、X(通常状况下是液态)、Y、Z(通常状况下是固态),它们共由5种短周期元素A、B、C、D、E组成。已知:①原子序数A<B<C<D<E,且A与D同族;C与E同族;B与C同周期。②W由A和B组成,且W分子中,A与B的原子个数比为4∶1;X由A和C组成,且X分子中A与C的原子个数比为1∶1;Y由C和D组成,属离子化合物,且测得Y固体中C与D的原子个数比为1∶1。③Z由D和E组成,属离子化合物,且其阳离子比阴离子少1个电子层,阳离子数与阴离子数之比为2∶1。试推断写出:
(1)W的化学式是________,W属于________化合物。
(2)X的电子式是________,X属于________化合物。
(3)1 mol Y在干燥的空气中质量会______(填“增大”或“减小”),其变化量(Δm)为________。
(4)用电子式表示化合物Z的形成过程________。
II.已知Si—Cl键、H—H键、H—Cl键、Si—Si键的键能分别为a kJ·mol-1、b kJ·mol-1、c kJ·mol-1、d kJ·mol-1,1 mol硅晶体含2 mol Si—Si键。工业上,提纯硅的化学方程式是SiCl4(g)+2H2(g)===Si(s)+4HCl(g) 则该反应的反应热是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将4gNaOH固体溶于水配成250mL溶液,此溶液中NaOH的物质的量浓度为___mol/L。取出10mL此溶液,其中含有NaOH_____g。将取出的溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为______mol/L。
(2)如图实验室某浓盐酸试剂瓶标签上的有关数据,据此计算:该浓盐酸中HCl的物质的量浓度为______mol/L;用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol/L的稀盐酸。需要量取______mL上述浓盐酸进行配制。

(3)100mL0.3mol/LNa2SO4溶液和50mL0.2mol/LAl2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为_______mol/L。
(4)标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.1L水(密度1 g/cm3)中,所得溶液的密度为d g/mL,则此溶液的物质的量浓度为__________mol/L。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com