
【题目】(1)将4gNaOH固体溶于水配成250mL溶液,此溶液中NaOH的物质的量浓度为___mol/L。取出10mL此溶液,其中含有NaOH_____g。将取出的溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为______mol/L。
(2)如图实验室某浓盐酸试剂瓶标签上的有关数据,据此计算:该浓盐酸中HCl的物质的量浓度为______mol/L;用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol/L的稀盐酸。需要量取______mL上述浓盐酸进行配制。

(3)100mL0.3mol/LNa2SO4溶液和50mL0.2mol/LAl2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为_______mol/L。
(4)标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.1L水(密度1 g/cm3)中,所得溶液的密度为d g/mL,则此溶液的物质的量浓度为__________mol/L。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
【答案】0.40.160.0411.916.80.4B
【解析】
(1)将4gNaOH固体溶于水配成250mL溶液,氢氧化钠的物质的量是4g÷40g/mol=0.1mol,则此溶液中NaOH的物质的量浓度为0.1mol÷0.25L=0.4mol/L。取出10mL此溶液,其中含有NaOH的质量是0.01L×0.4mol/L×40g/mol=0.16g。将取出的溶液加水稀释到100mL,由于稀释过程中溶质的物质的量不变,则稀释后溶液中NaOH的物质的量浓度为![]() =0.04mol/L。
=0.04mol/L。
(2)根据![]() 可知该浓盐酸中HCl的物质的量浓度为
可知该浓盐酸中HCl的物质的量浓度为![]() =11.9mol/L;由于稀释过程中溶质的物质的量不变,则用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol/L的稀盐酸,需要量取上述浓盐酸的体积为
=11.9mol/L;由于稀释过程中溶质的物质的量不变,则用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol/L的稀盐酸,需要量取上述浓盐酸的体积为![]() 。
。
(3)100mL0.3mol/LNa2SO4溶液和50mL0.2mol/LAl2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为![]() 。
。
(4)标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.1L水(密度1 g/cm3)中,溶质的物质的量是![]() ,质量是
,质量是![]() ,溶液质量是100g+
,溶液质量是100g+![]() ,所得溶液的密度为d g/mL,则此溶液的体积为
,所得溶液的密度为d g/mL,则此溶液的体积为![]() ,所以溶液的物质的量浓度为
,所以溶液的物质的量浓度为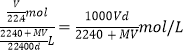 ,答案选B。
,答案选B。


科目:高中化学 来源: 题型:
【题目】某市售照明材料LED晶片是一种发光二极管。材质组成为:GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、GaInN(氮化镓铟)等。请回答下列问题:
(1)砷基态原子的核外电子排布式为______________________。
(2)上述非金属元素氢化物的沸点从高到低的顺序为___________。
(3)下列说法正确的是___________
a.电负性:As<Ga b.SiC与GaAs互为等电子体 c.第一电离能:As>Se>Ga
(4)如图所示为GaAs的晶胞结构,晶体熔点为1237℃。
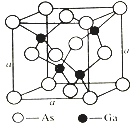
①晶胞中砷与镓原子间的化学键类型有___________。
②一个镓原子周围所有距离最近且相等的砷原子形成的空间构型是___________。
③一个晶胞的组成为___________。
④已知晶胞棱长a=5.64×10-10m,则该晶胞密度为ρ=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol O2在放电条件下发生下列反应:3O2![]() 2O3,如有30%O2转化为O3,则放电后混合气体对H2的相对密度是( )
2O3,如有30%O2转化为O3,则放电后混合气体对H2的相对密度是( )
A. 16 B. 17.8 C. 18.4 D. 35
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaOH固体配制一定物质的量浓度的NaOH溶液,下列操作中正确的是( )
A.称量时,将固体NaOH直接放在天平右盘上
B.将称量好的固体NaOH放入容量瓶中,加蒸馏水溶解
C.将烧杯中溶解固体NaOH所得溶液,冷却到室温后转移至容量瓶中
D.定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分离或提纯方法的叙述中,不正确的是( )
A.用酒精萃取碘水中的碘
B.用蒸馏的方法将自来水制成蒸馏水
C.用溶解、过滤的方法分离硝酸钾和沙子
D.用加热的方法分离氯化钠和氯化铵固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲除去下列物质中混入的少量杂质(括号内为杂质),所选试剂和分离方法都正确的是( )
A.CH4(Cl2):饱和食盐水洗气
B.C2H4(SO2):NaOH溶液洗气
C.溴苯(Br2):NaOH溶液蒸馏
D.FeCl3溶液(CuCl2):铁粉过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图:
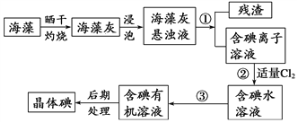
(1)提取碘的过程中有关的实验操作名称:①_______________,③_______________。
(2)提取碘的过程中,不能选择乙醇作有机萃取剂的原因是_____________________。
(3)第③步时使用的主要玻璃仪器有_______________________。
(4)小组用CCl4萃取碘水中的碘,在图中,下层液体呈______色;他们打开仪器下端的活塞,却未见液体流下,原因可能是_________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,关于等体积、等pH的稀盐酸和稀醋酸溶液,下列说法正确的是
A. 两溶液中c(OH-):盐酸<醋酸
B. 醋酸溶液中c(H+)=c(CH3COO-)
C. 中和同浓度NaOH溶液的能力:盐酸<醋酸
D. 分别用水稀释相同倍数后,两溶液pH仍相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为 。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为 。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如下表。

①HSO3-的电离平衡常数表达式K= 。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com