
【题目】下列有关物质分离或提纯方法的叙述中,不正确的是( )
A.用酒精萃取碘水中的碘
B.用蒸馏的方法将自来水制成蒸馏水
C.用溶解、过滤的方法分离硝酸钾和沙子
D.用加热的方法分离氯化钠和氯化铵固体
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)24.8 g Na2R含有Na+ 0.8 mol则R的摩尔质量为_________________。
(2)质量都为ag的镁和铝,物质的量之比为___________;将它们分别放入适量的盐酸溶液中恰好完全反应,则消耗的HCl的物质的量之比为___________。
(3)在标准状况下,CO和CO2混合气体的质量为36 g,体积为22.4 L,则其中CO2所占的体积为_________,CO所占的质量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出).其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体.

请填写下列空白:
(1)在周期表中,组成单质G的元素位于第 周期 族.
(2)在反应⑦中氧化剂与还原剂的物质的量之比为 .
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是 .(填写序号)
(4)反应④的离子方程式是: .
(5)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O.该反应的化学方程式是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度最大的是( )
A.250mL2mol/L的NaOH溶液B.500mL1mol/L的盐酸
C.100mL3mol/L的硫酸D.40mL5mol/L的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下合成甲醇的反应为;CO(g)+2H2(g)![]() CH3OH(g) △H1。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度,进行实验,测得相关数据如图(图1:温度分别为300℃ 、500℃的密闭容器中,甲醇的物质的量:图2:温度分别为Tl~T5的密闭容器中,反应均进行到5min时甲醇的体积分数)。下列叙述正确的是
CH3OH(g) △H1。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度,进行实验,测得相关数据如图(图1:温度分别为300℃ 、500℃的密闭容器中,甲醇的物质的量:图2:温度分别为Tl~T5的密闭容器中,反应均进行到5min时甲醇的体积分数)。下列叙述正确的是
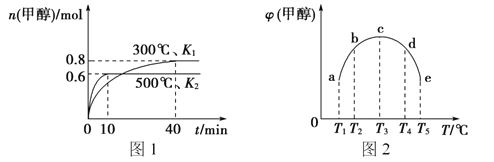
A. 该反应的△H1>0,且K1>K2
B. 将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或加压
C. 300℃时,向平衡后的容器中再充入0.8molCO, 0.6molH2,0.2molCH3OH,平衡正向移动
D. 500℃时,向平衡后的容器中再充入1molCH3OH,重新平衡后,H2浓度和百分含量均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将4gNaOH固体溶于水配成250mL溶液,此溶液中NaOH的物质的量浓度为___mol/L。取出10mL此溶液,其中含有NaOH_____g。将取出的溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为______mol/L。
(2)如图实验室某浓盐酸试剂瓶标签上的有关数据,据此计算:该浓盐酸中HCl的物质的量浓度为______mol/L;用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol/L的稀盐酸。需要量取______mL上述浓盐酸进行配制。

(3)100mL0.3mol/LNa2SO4溶液和50mL0.2mol/LAl2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为_______mol/L。
(4)标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.1L水(密度1 g/cm3)中,所得溶液的密度为d g/mL,则此溶液的物质的量浓度为__________mol/L。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究一溴环己烷(![]() )与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
)与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
甲:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成则可证明发生了消去反应。
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应。
其中正确的是( )
A. 甲 B. 乙 C. 丙 D. 上述实验方案都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2二溴乙烷的反应原理如下:CH3CH2OH![]() CH2=CH2+H2O,CH2=CH2+Br2―→BrCH2CH2Br。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:
CH2=CH2+H2O,CH2=CH2+Br2―→BrCH2CH2Br。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:

有关数据列表如下:
乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在装置c中应加入________(选填序号),其目的是吸收反应中可能生成的酸性气体。
①水 ②浓硫酸 ③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)装置b的作用是___________。
(3)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在水的________(填“上”或“下”)层。
(4)若产物中有少量未反应的Br2,最好用________(填正确选项前的序号)洗涤除去。
①水 ②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(5)反应过程中需用冷水冷却(装置e),但不用冰水进行过度冷却,原因是___________________________。
(6)以1,2二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2二溴乙烷通过反应①制得A,A通过反应②制得氯乙烯,由氯乙烯制得聚氯乙烯。
①________________(填反应类型) ②________________(填反应类型)
A________________(填该物质的电子式)
写出第一步反应①的化学方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ/mol N2(g) +2O2(g) = 2NO2(g)△H = +133kJ/mol、H2O(g) = H2O(l) △H = -44kJ/mol。催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为_____________________。
Ⅱ.脱碳:向2L密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:CO2(g) + 3H2(g) ![]() CH3OH(l) + H2O(l) △H < 0
CH3OH(l) + H2O(l) △H < 0
(1)①该反应自发进行的条件是__________(填“低温”、“高温”或“任意温度”),
②下列叙述能说明此反应达到平衡状态的是___________。
a.混合气体的平均式量保持不变 ;b.CO2和H2的体积分数保持不变;
c. CO2和H2的转化率相等 ;d.混合气体的密度保持不变
e.1molCO2生成的同时有3molH—H键断裂
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6内CO2的浓度随时间的变化_____。

(2)改变温度,使反应CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g) △H < 0中的所有物质都为气态。起始温度体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
CH3OH(g) + H2O(g) △H < 0中的所有物质都为气态。起始温度体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:

①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)_______K(II)(填“>”、“<”或“=”,下同);平衡时CH3OH的浓度c(I)_______c(II)。
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=_______________。在其它条件不变下,若30min时只改变温度为T2 ℃,此时H2的物质的量为3.2mol,则T1______T2(填“>”、“<”或“=”)。若30min时向容器中再充入1molCO2和1molH2O(g),则平衡_________移动(填“正向”、“逆向”或“不”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com