
【题目】常温下,关于等体积、等pH的稀盐酸和稀醋酸溶液,下列说法正确的是
A. 两溶液中c(OH-):盐酸<醋酸
B. 醋酸溶液中c(H+)=c(CH3COO-)
C. 中和同浓度NaOH溶液的能力:盐酸<醋酸
D. 分别用水稀释相同倍数后,两溶液pH仍相等
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】I、有4种化合物W(通常状况下是气态)、X(通常状况下是液态)、Y、Z(通常状况下是固态),它们共由5种短周期元素A、B、C、D、E组成。已知:①原子序数A<B<C<D<E,且A与D同族;C与E同族;B与C同周期。②W由A和B组成,且W分子中,A与B的原子个数比为4∶1;X由A和C组成,且X分子中A与C的原子个数比为1∶1;Y由C和D组成,属离子化合物,且测得Y固体中C与D的原子个数比为1∶1。③Z由D和E组成,属离子化合物,且其阳离子比阴离子少1个电子层,阳离子数与阴离子数之比为2∶1。试推断写出:
(1)W的化学式是________,W属于________化合物。
(2)X的电子式是________,X属于________化合物。
(3)1 mol Y在干燥的空气中质量会______(填“增大”或“减小”),其变化量(Δm)为________。
(4)用电子式表示化合物Z的形成过程________。
II.已知Si—Cl键、H—H键、H—Cl键、Si—Si键的键能分别为a kJ·mol-1、b kJ·mol-1、c kJ·mol-1、d kJ·mol-1,1 mol硅晶体含2 mol Si—Si键。工业上,提纯硅的化学方程式是SiCl4(g)+2H2(g)===Si(s)+4HCl(g) 则该反应的反应热是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将4gNaOH固体溶于水配成250mL溶液,此溶液中NaOH的物质的量浓度为___mol/L。取出10mL此溶液,其中含有NaOH_____g。将取出的溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为______mol/L。
(2)如图实验室某浓盐酸试剂瓶标签上的有关数据,据此计算:该浓盐酸中HCl的物质的量浓度为______mol/L;用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol/L的稀盐酸。需要量取______mL上述浓盐酸进行配制。

(3)100mL0.3mol/LNa2SO4溶液和50mL0.2mol/LAl2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为_______mol/L。
(4)标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.1L水(密度1 g/cm3)中,所得溶液的密度为d g/mL,则此溶液的物质的量浓度为__________mol/L。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂化可得到有机物(CH3)2C=C(CH3)2(以下用A表示)。
(1)A的系统命名为________;A在通常状况下呈________(填“气”“液”或“固”)态。
(2)A与Br2的加成产物B与NaOH的乙醇溶液共热可生成二烯烃C,则C的结构简式为___________________;B生成C的反应类型为________。
(3)C与一定量Br2反应可能生成D、E和G,而D与HBr的加成产物只有F,则D形成高分子化合物的化学方程式为__________________________________________。
(4)C的同分异构体中不可能为________(填字母)
a.芳香烃 b.炔烃 c.环烯烃 d.二烯烃
若C的一种同分异构体H与KMnO4酸性溶液生成己二酸,则H的结构简式为________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2二溴乙烷的反应原理如下:CH3CH2OH![]() CH2=CH2+H2O,CH2=CH2+Br2―→BrCH2CH2Br。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:
CH2=CH2+H2O,CH2=CH2+Br2―→BrCH2CH2Br。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:

有关数据列表如下:
乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在装置c中应加入________(选填序号),其目的是吸收反应中可能生成的酸性气体。
①水 ②浓硫酸 ③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)装置b的作用是___________。
(3)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在水的________(填“上”或“下”)层。
(4)若产物中有少量未反应的Br2,最好用________(填正确选项前的序号)洗涤除去。
①水 ②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(5)反应过程中需用冷水冷却(装置e),但不用冰水进行过度冷却,原因是___________________________。
(6)以1,2二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2二溴乙烷通过反应①制得A,A通过反应②制得氯乙烯,由氯乙烯制得聚氯乙烯。
①________________(填反应类型) ②________________(填反应类型)
A________________(填该物质的电子式)
写出第一步反应①的化学方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近些年,地表水和地下水域 中的高氯酸盐污染及其降解受到环境工作者的关注。某科研小组研究了一定条件 下温度、酸碱性对其降解的影响(初始质量浓度均为100mg/L),测得数据如图所示,下列说法不正确的是
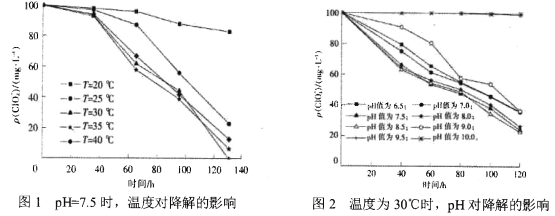
A. 在pH=7.5、温度为35℃时,0~60 h内高氯酸盐的降解平均速率为1mg/(L· h)
B. 当pH=7.5时,高氯酸盐降解最适宜温度为30℃
C. 当温度一定时,随pH的减小,高氯酸盐的降解速率不一定增大
D. 当降解时间为100h时 ,pH=7.5、温度为28℃与pH=7.3、温度为30℃两种条件下高氯酸盐的降解率可能相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)质量比为16∶7∶ 6的三种气体 SO2、CO、NO,分子个数之比为________;相同条件下体积比为________。
(2)在标准状况下,1.7 g NH3所占的体积为________L,它与标准状况下________L H2S含有相同数目的H原子。
(3)某气体氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为________,R的相对原子质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是 ( )。
A. 现代药物主要是人工合成的药物
B. 天然药物具有良好的药效,所以不需要进行改造
C. 药物的生物活性跟它的结构中的某些官能团有关
D. 在药物设计领域计算机应用前景广阔
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com