
【题目】I、有4种化合物W(通常状况下是气态)、X(通常状况下是液态)、Y、Z(通常状况下是固态),它们共由5种短周期元素A、B、C、D、E组成。已知:①原子序数A<B<C<D<E,且A与D同族;C与E同族;B与C同周期。②W由A和B组成,且W分子中,A与B的原子个数比为4∶1;X由A和C组成,且X分子中A与C的原子个数比为1∶1;Y由C和D组成,属离子化合物,且测得Y固体中C与D的原子个数比为1∶1。③Z由D和E组成,属离子化合物,且其阳离子比阴离子少1个电子层,阳离子数与阴离子数之比为2∶1。试推断写出:
(1)W的化学式是________,W属于________化合物。
(2)X的电子式是________,X属于________化合物。
(3)1 mol Y在干燥的空气中质量会______(填“增大”或“减小”),其变化量(Δm)为________。
(4)用电子式表示化合物Z的形成过程________。
II.已知Si—Cl键、H—H键、H—Cl键、Si—Si键的键能分别为a kJ·mol-1、b kJ·mol-1、c kJ·mol-1、d kJ·mol-1,1 mol硅晶体含2 mol Si—Si键。工业上,提纯硅的化学方程式是SiCl4(g)+2H2(g)===Si(s)+4HCl(g) 则该反应的反应热是_______________。
【答案】 CH4 共价 ![]() 共价 增大 28 g
共价 增大 28 g ![]() (4a+2b-4c-2d)kJ/mol
(4a+2b-4c-2d)kJ/mol
【解析】I、5种短周期元素A、B、C、D、E,①A与D同族、C与E同族、B与C同周期,且原子序数A<B<C<D<E,可知B、C处于第二周期,D、E处于第三周期;②气态W由A和B组成,且W分子中,A与B的原子个数比为4:1;液态X由A和C组成,且X分子中A与C的原子个数比为1:1,可推知A为H元素、B为C元素、C为O元素,W为CH4、X为H2O2,Y由C和D组成,属离子化合物,且测得Y固体中C与D的原子个数比为1:1,则D为Na,Y为Na2O2;③Z由D和E组成,属离子化合物,且其阳离子比阴离子少1个电子层,阳离子数与阴离子数之比为2:1,则E为S,Z为Na2S。
(1)由以上分析可知W为CH4,为共价化合物,故答案为:CH4;共价;
(2)X为H2O2,电子式是![]() ,X属于共价化合物,故答案为:
,X属于共价化合物,故答案为:![]() ;共价;
;共价;
(3)Na2O2与CO2反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,固体质量增加为与二氧化碳等物质的量的CO的质量,故1molNa2O2反应固体质量增重为1mol×28g/mol=28g,
故答案为:增大;28g;
(4)Z为Na2S,属于离子化合物,用电子式表示其形成过程为![]() ,故答案为:
,故答案为:![]() .
.
II.反应热=反应物的键能之和-生成物的键能之和,即△H=akJ/mol×4+bkJ/mol×2 -dkJ/mol×2-ckJ/mol×4 =+(4a+2b-4c-2d)kJ/mol,故答案为:(4a+2b-4c-2d)kJ/mol。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在元素周期表中的相对位置如下表所示。下列判断正确的是( )

A. 原子半径:丙<丁<戊 B. 金属性:甲>丙
C. 氢氧化物碱性:丙>丁>戊 D. 最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市售照明材料LED晶片是一种发光二极管。材质组成为:GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、GaInN(氮化镓铟)等。请回答下列问题:
(1)砷基态原子的核外电子排布式为______________________。
(2)上述非金属元素氢化物的沸点从高到低的顺序为___________。
(3)下列说法正确的是___________
a.电负性:As<Ga b.SiC与GaAs互为等电子体 c.第一电离能:As>Se>Ga
(4)如图所示为GaAs的晶胞结构,晶体熔点为1237℃。
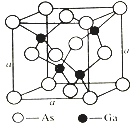
①晶胞中砷与镓原子间的化学键类型有___________。
②一个镓原子周围所有距离最近且相等的砷原子形成的空间构型是___________。
③一个晶胞的组成为___________。
④已知晶胞棱长a=5.64×10-10m,则该晶胞密度为ρ=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,用0.1000mol/L NaOH溶液滴定25.00mL 0.1000mol/L某一元酸HX溶液,滴定过程中pH变化曲线如下图所示。下列说法不正确的是( )

A. 在A点:c(HX)>c(Na+)>c(X-)
B. 在B点,溶液中c(H+)=c(OH-)
C. C点溶液中存在的主要平衡是X- + H2O![]() HX+OH-
HX+OH-
D. 0.05mol/L NaX溶液的pH ≈ 9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO![]() 的物质的量浓度为3 mol·L-1,则此溶液最多溶解铁粉的质量为( )信息:Fe2(SO4)3+Fe=3FeSO4
的物质的量浓度为3 mol·L-1,则此溶液最多溶解铁粉的质量为( )信息:Fe2(SO4)3+Fe=3FeSO4
A. 5.6 g B. 11.2 g C. 22.4 g D. 33.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol O2在放电条件下发生下列反应:3O2![]() 2O3,如有30%O2转化为O3,则放电后混合气体对H2的相对密度是( )
2O3,如有30%O2转化为O3,则放电后混合气体对H2的相对密度是( )
A. 16 B. 17.8 C. 18.4 D. 35
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaOH固体配制一定物质的量浓度的NaOH溶液,下列操作中正确的是( )
A.称量时,将固体NaOH直接放在天平右盘上
B.将称量好的固体NaOH放入容量瓶中,加蒸馏水溶解
C.将烧杯中溶解固体NaOH所得溶液,冷却到室温后转移至容量瓶中
D.定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,关于等体积、等pH的稀盐酸和稀醋酸溶液,下列说法正确的是
A. 两溶液中c(OH-):盐酸<醋酸
B. 醋酸溶液中c(H+)=c(CH3COO-)
C. 中和同浓度NaOH溶液的能力:盐酸<醋酸
D. 分别用水稀释相同倍数后,两溶液pH仍相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com