
【题目】回答下列问题
(1)质量比为16∶7∶ 6的三种气体 SO2、CO、NO,分子个数之比为________;相同条件下体积比为________。
(2)在标准状况下,1.7 g NH3所占的体积为________L,它与标准状况下________L H2S含有相同数目的H原子。
(3)某气体氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为________,R的相对原子质量为________。
【答案】5:5:45:5:42.243.3664g/mol32
【解析】
(1)质量比为16∶7∶ 6的三种气体SO2、CO、NO物质的量之比为16/64:7/27:6/30=5:5:4,故三者分子数目之比为5:5:4 , 根据阿伏伽德罗定律在相同条件下体积比等于物质的量之比,所以体积比为5:5:4。 因此答案是: 5:5:4 5:5:4 。
(2) 1.7 g氨气物质的量为1.7 g/ 17 g![]() mol-1=0.1mol ,氨气体积为0.1mol
mol-1=0.1mol ,氨气体积为0.1mol![]() 22.4L/mol=2.24L ,与含有相同H原子数目的硫化氢的物质的量为
22.4L/mol=2.24L ,与含有相同H原子数目的硫化氢的物质的量为![]() mol标准状况下H2S的体积为:0.15mol
mol标准状况下H2S的体积为:0.15mol![]() =3.36L因此,本题正确答案是:2.24; 3.36;
=3.36L因此,本题正确答案是:2.24; 3.36;
(3)氧化物的物质的量为(448 mL![]() 10-3)/ 22.4L
10-3)/ 22.4L![]() mol-1=0.02mol氧化物的摩尔质量为1.28 g /0.02mol=64g/mol,R的相对原子质量为64-32=32,因此,本题正确答案是64g/mol:;32.
mol-1=0.02mol氧化物的摩尔质量为1.28 g /0.02mol=64g/mol,R的相对原子质量为64-32=32,因此,本题正确答案是64g/mol:;32.


科目:高中化学 来源: 题型:
【题目】1mol O2在放电条件下发生下列反应:3O2![]() 2O3,如有30%O2转化为O3,则放电后混合气体对H2的相对密度是( )
2O3,如有30%O2转化为O3,则放电后混合气体对H2的相对密度是( )
A. 16 B. 17.8 C. 18.4 D. 35
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图:
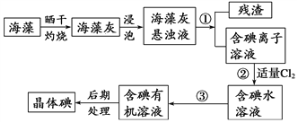
(1)提取碘的过程中有关的实验操作名称:①_______________,③_______________。
(2)提取碘的过程中,不能选择乙醇作有机萃取剂的原因是_____________________。
(3)第③步时使用的主要玻璃仪器有_______________________。
(4)小组用CCl4萃取碘水中的碘,在图中,下层液体呈______色;他们打开仪器下端的活塞,却未见液体流下,原因可能是_________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,关于等体积、等pH的稀盐酸和稀醋酸溶液,下列说法正确的是
A. 两溶液中c(OH-):盐酸<醋酸
B. 醋酸溶液中c(H+)=c(CH3COO-)
C. 中和同浓度NaOH溶液的能力:盐酸<醋酸
D. 分别用水稀释相同倍数后,两溶液pH仍相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)3.01×1023个HNO3的物质的量是_________
(2)HNO3的摩尔质量是____________________;94.5g HNO3的物质的量是_______________
(3)1.5NA个H2O中,H原子的物质的量是__________
(4)6.02×1023个H2SO4分子中H+的质量为___________
(5)9g NH4+中的原子数目是______________;电子数目是________________
(6)含a g Cu2+的CuCl2中Cl- 的个数___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A.稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑
B.硫酸钠与氯化钡溶液混和:SO42﹣+Ba2+═BaSO4↓
C.硝酸滴在石灰石上:CaCO3+2H+═Ca2++H2CO3
D.氧化铜与硫酸混和:Cu2++SO42﹣═CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取不同质量由 Ba(OH)2和 BaCO3组成的均匀混合样品,先加适量的水溶解,然后加入100mL某浓度稀盐酸,所得CO2气 体的体积(己换算为标准状况)与加入样品的质量关系如图所示(不考虑CO2的溶解、反应及碳酸氢盐的生成)。请计算:
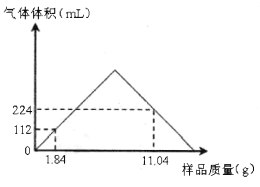
(1)混合物中Ba(OH)2和 BaCO3物质的量之比为________。
(2)稀盐酸物质的量浓度为________mo1/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为 。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为 。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如下表。

①HSO3-的电离平衡常数表达式K= 。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)100mL0.2mol/L Na2SO4溶液中含有SO42﹣___________________mol,Na+的物质的量浓度是_________________mol/L。
(2)5molCO2在标准状况下所占的体积约为________L;所含氧原子的数目约为_______个。
(3)3.01×1023个OH﹣的物质的量为___mol,质量为______g,含有电子的物质的量为_______mol,这些OH﹣与___________mol NH3的质量相同。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com