
【题目】研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为 。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为 。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如下表。

①HSO3-的电离平衡常数表达式K= 。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。
【答案】(1)①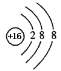 ;②C+2H2SO4(浓)
;②C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O;
2SO2↑+CO2↑+2H2O;
(2)①0.043;②5。
(3)①![]() ;②c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
;②c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
③H2SO3+HCO3-=HSO3-+CO2↑+H2O
【解析】
试题分析:(1)①S是16号元素。S原子获得2个电子变为S2-,硫离子的结构示意图为 。
。
②加热时,浓硫酸与木炭发生反应产生SO2、CO2和水,反应的化学方程式为C+2H2SO4(浓)![]() 2SO2↑ +CO2↑+2H2O;
2SO2↑ +CO2↑+2H2O;
(2)①根据图像可知,在pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol·L-1H2S溶液中,根据S元素守恒可知:c(S2-)+ c(H2S)+c(HS-)=0.1 mol/L,而c(S2-)=5.7×10-2mol/L,因此c(H2S)+c(HS-)=0.1 mol/L -5.7×10-2 mol/L=0.043 mol/L。
②由于Ksp(MnS)=2.8×10-23,在某溶液c(Mn2+)=0.020 mol·L-1,则开始形成沉淀需要的S2-的浓度是c(S2-)= Ksp(MnS)÷c(Mn2+)=2.8×10-13÷0.020 mol/L=1.4×10-11 mol/L,根据图像中c(S2-)与溶液的pH关系可知,此时溶液pH=5,Mn2+开始形成沉淀。
(3)①根据电离平衡常数的含义可知HSO3-的电离平衡常数表达式是 。
。
②Na2SO3在溶液中电离的方程式是Na2SO3=2Na++SO32-,该盐是强碱弱酸盐,弱酸根离子SO32-发生水解反应:SO32-+H2O![]() HSO3-+OH-,水解产生的HSO3-又有部分发生水解反应:HSO3-+H2O
HSO3-+OH-,水解产生的HSO3-又有部分发生水解反应:HSO3-+H2O![]() H2SO3 +OH-,水解是逐步进行的,而且在溶液中还存在水的电离平衡,但是盐水解程度是微弱的,主要以盐电离产生的离子存在,所以0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)。
H2SO3 +OH-,水解是逐步进行的,而且在溶液中还存在水的电离平衡,但是盐水解程度是微弱的,主要以盐电离产生的离子存在,所以0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)。
③由于多元弱酸分步电离,电离程度:一级电离>二级电离,电离程度越大,电离平衡常数就越大。所以根据表格数据可知H2SO3的二级电离平衡常数大于H2CO3的一级电离平衡常数,故H2SO3溶液和NaHCO3溶液反应的主要是复分解反应的规律:强酸与弱酸的盐发生反应制取弱酸。其离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O。


科目:高中化学 来源: 题型:
【题目】(1)将4gNaOH固体溶于水配成250mL溶液,此溶液中NaOH的物质的量浓度为___mol/L。取出10mL此溶液,其中含有NaOH_____g。将取出的溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为______mol/L。
(2)如图实验室某浓盐酸试剂瓶标签上的有关数据,据此计算:该浓盐酸中HCl的物质的量浓度为______mol/L;用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol/L的稀盐酸。需要量取______mL上述浓盐酸进行配制。

(3)100mL0.3mol/LNa2SO4溶液和50mL0.2mol/LAl2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为_______mol/L。
(4)标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.1L水(密度1 g/cm3)中,所得溶液的密度为d g/mL,则此溶液的物质的量浓度为__________mol/L。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)质量比为16∶7∶ 6的三种气体 SO2、CO、NO,分子个数之比为________;相同条件下体积比为________。
(2)在标准状况下,1.7 g NH3所占的体积为________L,它与标准状况下________L H2S含有相同数目的H原子。
(3)某气体氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为________,R的相对原子质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是 ( )。
A. 现代药物主要是人工合成的药物
B. 天然药物具有良好的药效,所以不需要进行改造
C. 药物的生物活性跟它的结构中的某些官能团有关
D. 在药物设计领域计算机应用前景广阔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ/mol N2(g) +2O2(g) = 2NO2(g)△H = +133kJ/mol、H2O(g) = H2O(l) △H = -44kJ/mol。催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为_____________________。
Ⅱ.脱碳:向2L密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:CO2(g) + 3H2(g) ![]() CH3OH(l) + H2O(l) △H < 0
CH3OH(l) + H2O(l) △H < 0
(1)①该反应自发进行的条件是__________(填“低温”、“高温”或“任意温度”),
②下列叙述能说明此反应达到平衡状态的是___________。
a.混合气体的平均式量保持不变 ;b.CO2和H2的体积分数保持不变;
c. CO2和H2的转化率相等 ;d.混合气体的密度保持不变
e.1molCO2生成的同时有3molH—H键断裂
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6内CO2的浓度随时间的变化_____。

(2)改变温度,使反应CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g) △H < 0中的所有物质都为气态。起始温度体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
CH3OH(g) + H2O(g) △H < 0中的所有物质都为气态。起始温度体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:

①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)_______K(II)(填“>”、“<”或“=”,下同);平衡时CH3OH的浓度c(I)_______c(II)。
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=_______________。在其它条件不变下,若30min时只改变温度为T2 ℃,此时H2的物质的量为3.2mol,则T1______T2(填“>”、“<”或“=”)。若30min时向容器中再充入1molCO2和1molH2O(g),则平衡_________移动(填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用FeS处理含Cu2+和Pb2+废水后的废弃固体(主要成分CuS、FeS、PbS、SiO2)制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:

(1)提高步骤①反应速率的措施,除温度外,还有_____________(写一条);
(2)处理废水时,FeS与Pb2+反应的离子方程式为____________;
(3)固体A的主要成分是_______________(填化学式);
(4)步骤⑤中,所加试剂x为____________(填标号);
a.Cl2 b.H2O2 c.KMnO4 d.HNO3
(5)检验溶液B完全转化为溶液C的试剂是_________________________;
(6)潮湿多雨的夏季,在细菌作用下,废石堆中的硫化铜与硫酸铁转化为含重金属盐的酸性废水(硫元素全部进入溶液中)而污染土壤。该转化反应的离子方程式为____________;
(7)已知,常温下FeS、CuS的Ksp分别为6.5x10-18和1.3x10-36)。现用过量的FeS处理含0.01mol·L-1 Cu2+的废水,处理后废水中c(Cu2+)=______mol·L-1(忽略体积变化)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com