
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
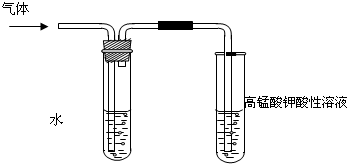 学习卤代烃的性质时,张老师通过实验的方法验证溴乙烷在不同溶剂中与NaOH 反应生成不同的反应产物,请你一起参与他们的探究.
学习卤代烃的性质时,张老师通过实验的方法验证溴乙烷在不同溶剂中与NaOH 反应生成不同的反应产物,请你一起参与他们的探究.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油裂解和油脂皂化都是由高分子生成小分子的过程 |
| B、丙烯分子中所有原子不可能在同一平面上 |
| C、(CH3)3CCH2CH3的一氯代物有3种 |
| D、甲苯的硝化、乙酸乙酯的水解均可看作取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、②③ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuCl2═Cu2++Cl2- |
| B、HCO3-═H++CO32- |
| C、Fe2(SO4)3═2Fe2++3SO42- |
| D、Ba(NO3)2═Ba2++2(NO3)2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用活性炭去除冰箱中的异味 |
| B、用热碱水清除炊具上残留的油污 |
| C、用浸泡过高锰酸钾溶液的硅藻土保鲜水果 |
| D、用含硅胶、铁粉的透气小袋与食品一起密封包装 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:| 化学键 | C-H | Cl-Cl | C-Cl | H-Cl |
| 键能/kJ?mol-1 | X | 243 | 330 | 432 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com