

| △V |
| △t |
| △V |
| △t |


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
| A、加热后的蒸发皿,要用坩埚钳夹取 | ||
| B、试管和烧杯都可以直接在火焰上加热 | ||
C、给试管里的液体加热,液体的体积一般不超过试管容积的
| ||
| D、用剩的药品不要乱丢,要放回原试剂瓶里 |
查看答案和解析>>
科目:高中化学 来源: 题型:
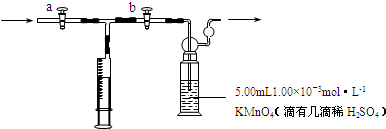
查看答案和解析>>
科目:高中化学 来源: 题型:
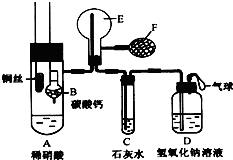 为了证明铜与稀硝酸反应产生的是NO,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,
为了证明铜与稀硝酸反应产生的是NO,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,查看答案和解析>>
科目:高中化学 来源: 题型:
 合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.
合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.| 实验操作步骤 | 实验现象 | 结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
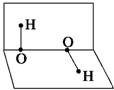 已知H2O2的分子空间结构可在二面角中表示,如图所示,则有关H2O2的结构的说法中不正确的是( )
已知H2O2的分子空间结构可在二面角中表示,如图所示,则有关H2O2的结构的说法中不正确的是( )| A、分子的正、负电荷重心不重合 |
| B、H2O2分子内既含极性键又含非极性键 |
| C、H2O2是极性分子 |
| D、H2O2分子间不可能形成氢键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com