



 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
| A、石油裂解和油脂皂化都是由高分子生成小分子的过程 |
| B、丙烯分子中所有原子不可能在同一平面上 |
| C、(CH3)3CCH2CH3的一氯代物有3种 |
| D、甲苯的硝化、乙酸乙酯的水解均可看作取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:| 化学键 | C-H | Cl-Cl | C-Cl | H-Cl |
| 键能/kJ?mol-1 | X | 243 | 330 | 432 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molCl2参加的任何反应,反应过程中转移电子数都是2NA | ||
| B、常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA | ||
C、标准状况下,1L乙醇完全燃烧产生CO2分子的数目为
| ||
| D、将10mL质量分数为98%的浓H2SO4,用水稀释至100mL,H2SO4的质量分数大于9.8% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲试管 | B、乙试管 |
| C、丙试管 | D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
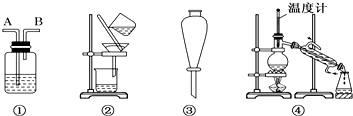
| 选项 | 物质 | 试剂 | 装置 |
| A | C2H6(C2H4) | ① | ① |
| B | 溴苯(溴) | ② | ③ |
| C | CH3COOC2H5(CH3COOH) | ③ | ② |
| D | 甲苯(二甲苯) | ① | ③ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com