
| A、1molCl2参加的任何反应,反应过程中转移电子数都是2NA | ||
| B、常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA | ||
C、标准状况下,1L乙醇完全燃烧产生CO2分子的数目为
| ||
| D、将10mL质量分数为98%的浓H2SO4,用水稀释至100mL,H2SO4的质量分数大于9.8% |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、H+、Fe2+、ClO-、SO42- |
| B、Na+、Cu2+、S2-、ClO- |
| C、Na+、Ba2+、OH-、NO3- |
| D、Na+、Al3+、SiO32-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
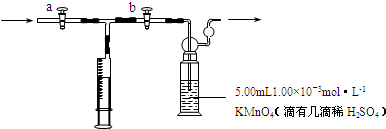
查看答案和解析>>
科目:高中化学 来源: 题型:
 合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.
合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.| 实验操作步骤 | 实验现象 | 结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
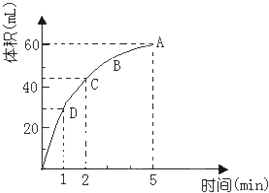 为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于50mL密度为1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如图所示.请依图回答下列问题:
为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于50mL密度为1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如图所示.请依图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有元素中原子半径最小的是F |
B、根据π键的成键特征判断C-C的键能与  键能的关系是双键的键能小于单键的键能的2倍 键能的关系是双键的键能小于单键的键能的2倍 |
| C、元素电负性越小,元素非金属性越强 |
| D、第n周期第n主族的元素均为金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显红色,它们相互转化关系如图所示.
A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显红色,它们相互转化关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com