
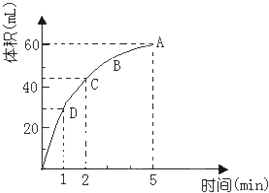
 为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于50mL密度为1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如图所示.请依图回答下列问题:
为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于50mL密度为1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如图所示.请依图回答下列问题:
| ||
| ||
| ||
| 2mol×0.06L |
| 22.4L |
| 0.00536mol |
| 0.05L |


科目:高中化学 来源: 题型:
A、 |
B、 |
C、 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如图所示的实验装置.请你根据他们的思路,完成下述的实验报告.
某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如图所示的实验装置.请你根据他们的思路,完成下述的实验报告.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molCl2参加的任何反应,反应过程中转移电子数都是2NA | ||
| B、常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA | ||
C、标准状况下,1L乙醇完全燃烧产生CO2分子的数目为
| ||
| D、将10mL质量分数为98%的浓H2SO4,用水稀释至100mL,H2SO4的质量分数大于9.8% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Q1+Q2+Q3 |
| B、0.5(Q1+Q2+Q3) |
| C、0.5 Q1-1.5 Q2+0.5Q3 |
| D、1.5Q1-0.5Q2+0.5Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A为中学化学中的一种深蓝色盐,B、C为日常生活中常见的金属单质,D、G为无色无味气体,各物质之间的转化关系如下图(电解采用惰性电极,部分反应产物已略去).请回答下列问题:
已知A为中学化学中的一种深蓝色盐,B、C为日常生活中常见的金属单质,D、G为无色无味气体,各物质之间的转化关系如下图(电解采用惰性电极,部分反应产物已略去).请回答下列问题:| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| H溶液的体积(mL) | 100 | 100 | 100 | 100 |
| 加入B、C合金的质量(g) | 3 | 6.6 | 9 | 12 |
| 剩余固体的质量(g) | 0 | 0.64 | 3.2 | 6.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com