
 已知A为中学化学中的一种深蓝色盐,B、C为日常生活中常见的金属单质,D、G为无色无味气体,各物质之间的转化关系如下图(电解采用惰性电极,部分反应产物已略去).请回答下列问题:
已知A为中学化学中的一种深蓝色盐,B、C为日常生活中常见的金属单质,D、G为无色无味气体,各物质之间的转化关系如下图(电解采用惰性电极,部分反应产物已略去).请回答下列问题:| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| H溶液的体积(mL) | 100 | 100 | 100 | 100 |
| 加入B、C合金的质量(g) | 3 | 6.6 | 9 | 12 |
| 剩余固体的质量(g) | 0 | 0.64 | 3.2 | 6.4 |
| ||
| 22.4L×0.1mol/L×0.1L |
| 4mol |
| 1.4g |
| 56g/mol |
| 1.6g |
| 64g/mol |


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
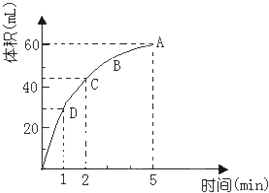 为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于50mL密度为1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如图所示.请依图回答下列问题:
为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于50mL密度为1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如图所示.请依图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | W | X | Y | Z |
| A | CH3COOC2H5 | CH3COOH | Na2CO3溶液 | 分液 |
| B | CO2 | SO2 | 饱和Na2CO3溶液 | 洗气 |
| C | NaCl固体 | I2 | CCl4 | 分液 |
| D | Na2CO3溶液 | NaHCO3溶液 | Ca(OH)2溶液 | 过滤 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显红色,它们相互转化关系如图所示.
A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显红色,它们相互转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| 正极 | 负极 | 电解质溶液 | |
| A | Zn | Cu | CuCl2 |
| B | Cu | Zn | H2SO4 |
| C | Cu | Zn | CuSO4 |
| D | Zn | Fe | CuCl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com