
| m |
| M |
| n |
| V |
| n |
| c |
| 10g |
| 400g/mol |
| 0.025mol |
| 0.1L |
| 0.005mol |
| 0.05mol/L |


科目:高中化学 来源: 题型:
 已知A为中学化学中的一种深蓝色盐,B、C为日常生活中常见的金属单质,D、G为无色无味气体,各物质之间的转化关系如下图(电解采用惰性电极,部分反应产物已略去).请回答下列问题:
已知A为中学化学中的一种深蓝色盐,B、C为日常生活中常见的金属单质,D、G为无色无味气体,各物质之间的转化关系如下图(电解采用惰性电极,部分反应产物已略去).请回答下列问题:| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| H溶液的体积(mL) | 100 | 100 | 100 | 100 |
| 加入B、C合金的质量(g) | 3 | 6.6 | 9 | 12 |
| 剩余固体的质量(g) | 0 | 0.64 | 3.2 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、w=
| ||
B、w=
| ||
C、C=
| ||
D、b=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应中的能量变化,表现形式除热量外还可以是光能和电能等 |
| B、化学反应中的能量变化不一定服从能量守恒定律 |
| C、在一个确定的化学反应关系中,反应物的总能量与生成物的总能量可能相同 |
| D、在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、150 mL 3 mol?L-1的KCl溶液 |
| B、75 mL 2.5 mol?L-1的CaCl2溶液 |
| C、150 mL 3 mol?L-1KClO3溶液 |
| D、25 mL 2 mol?L-1的FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
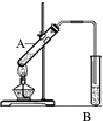 (1)实验室用右图所示装置制取乙酸乙酯,在试管A中加入的试剂有无水酒精、浓硫酸和冰醋酸(CH3COOH).请写出该反应的化学方程式)
(1)实验室用右图所示装置制取乙酸乙酯,在试管A中加入的试剂有无水酒精、浓硫酸和冰醋酸(CH3COOH).请写出该反应的化学方程式)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com