
| A、2.5% | B、5% |
| C、6.5% | D、7.5% |
| 1 |
| 12 |


科目:高中化学 来源: 题型:
 A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显红色,它们相互转化关系如图所示.
A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显红色,它们相互转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
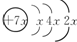 ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期除稀有气体外半径最大的元素,C的最外层有三个单电子,E的外围电子排布式为3d64s2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、控制含磷洗涤剂的生产和使用,防止水体富营养化,保护水资源 |
| B、研究采煤、采油新技术,大量开发新矿山,提高产量以满足工业生产的快速发展 |
| C、开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料 |
| D、实现资源的“3R”利用,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、提高资源的循环利用(Recycle),以此来推进生态文明建设 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 钾的化学性质非常活泼在氧气中燃烧能生成 超氧化钾晶体(KO2),其结构如图所示为该晶体的一个晶胞(晶体中最小重复单元).下列有关说法正确的是( )
钾的化学性质非常活泼在氧气中燃烧能生成 超氧化钾晶体(KO2),其结构如图所示为该晶体的一个晶胞(晶体中最小重复单元).下列有关说法正确的是( )| A、晶体中所有原子间都以离子键结合 |
| B、晶体中与每个K+距离最近且相等的O2-有6个,距离最近且相等的K+有12个 |
| C、该晶体的化学式为KO2,则每个晶胞中只有1个K+和1个O2- |
| D、该晶体中阴阳离子个数之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| ①取5ml0.2mol?L-1的Fe(NO3)3溶液和5ml0.2mol?L-1的KI溶液,充分反应后加入5ml CCl4溶液,振荡静置,取上层溶液,分置于A、B两支试管中 | |
| ② ③ | 若溶液不变红色,则假设1成立,否则假设1不成立; 若溶液显紫色,则假设2成立,否则假设2不成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com