


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
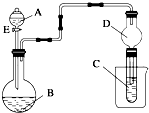 用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
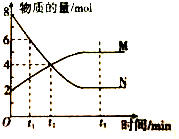
| A、反应的化学方程式:2N?M |
| B、t2时,正、逆反应速率相等,达到平衡 |
| C、t3时,正反应速率大于逆反应速率 |
| D、反应开始时只投入了N |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、往容量瓶中转移溶液时有少量液体溅出 |
| B、洗净的容量瓶未干燥立即用来配制溶液 |
| C、定容时俯视刻度线 |
| D、定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
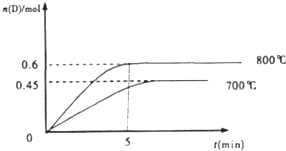
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有阴离子的晶体一定有阳离子,有阳离子的晶体也一定有阴离子 |
| B、只含有非极性键的分子一定是非极性分子,只含有极性键的分子也一定是极性分子 |
| C、离子化合物中可能存在共价键,共价化合物中也可能存在离子键 |
| D、范德华力属于分子间作用力,但氢键不一定属于分子间作用力 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com