
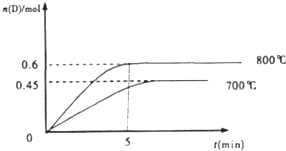
| ||
| △t |
| ||
| 5min |
| 1-0.6 |
| 2 |
| 0.6mol |
| 2L |
| 0.3×0.3 |
| 0.2×0.52 |
| 1×2 |
| 0.6×12 |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| ①取5ml0.2mol?L-1的Fe(NO3)3溶液和5ml0.2mol?L-1的KI溶液,充分反应后加入5ml CCl4溶液,振荡静置,取上层溶液,分置于A、B两支试管中 | |
| ② ③ | 若溶液不变红色,则假设1成立,否则假设1不成立; 若溶液显紫色,则假设2成立,否则假设2不成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v逆(H2O)=v正(CO) |
| B、容器中物质的总质量不发生变化 |
| C、n(H2O):n(H2)=1:1 |
| D、生成1molCO的同时生成1molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
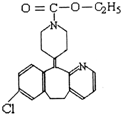 开瑞坦是治疗过敏性鼻炎的良药,其有效成分的结构简式如图所示,下列关于该有机物的说法正确的是( )
开瑞坦是治疗过敏性鼻炎的良药,其有效成分的结构简式如图所示,下列关于该有机物的说法正确的是( )| A、该有机物的分子式是C22H23N2O2Cl |
| B、分子中含有四个六元环,其中有一个是苯环 |
| C、1mol分子发生水解反应后能得到2mol新分子 |
| D、1mol分子发生加成反应需要8mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸发是为了除去溶剂得到晶体,蒸馏是为了得到液体成分 |
| B、金属氧化物一定是碱性氧化物 |
| C、酸性氧化物一定是非金属氧化物 |
| D、物质的量是七个基本物理量之一,是用于描述一定粒子数目的物理量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com