
| 实验步骤 | 预期现象和结论 |
| ①取5ml0.2mol?L-1的Fe(NO3)3溶液和5ml0.2mol?L-1的KI溶液,充分反应后加入5ml CCl4溶液,振荡静置,取上层溶液,分置于A、B两支试管中 | |
| ② ③ | 若溶液不变红色,则假设1成立,否则假设1不成立; 若溶液显紫色,则假设2成立,否则假设2不成立 |
| 实验步骤 | 预期现象和结论 |
| ②向试管A中加入1~2滴0.01 mol?L-1的KSCN溶液 ③向试管B中加入1~2滴0.01 mol?L-1的 KMnO4酸性溶液 |


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
| A、1 mol氦气分子中含2NA个氦原子 |
| B、25℃时,l L pH=13的Ba(OH)2 溶液中含有OH-的数目为0.1NA |
| C、1.8 g重水(21H2O)中所含质子的个数为NA |
| D、1L 0.2mol/L的FeCl3溶液中Fe3+的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
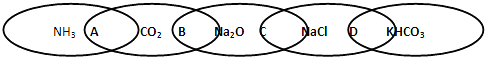
| A、两种物质都是电解质 |
| B、两种物质都是氧化物 |
| C、两种物质都是钠的化合物 |
| D、两种物质都是盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
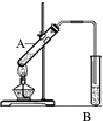 (1)实验室用右图所示装置制取乙酸乙酯,在试管A中加入的试剂有无水酒精、浓硫酸和冰醋酸(CH3COOH).请写出该反应的化学方程式)
(1)实验室用右图所示装置制取乙酸乙酯,在试管A中加入的试剂有无水酒精、浓硫酸和冰醋酸(CH3COOH).请写出该反应的化学方程式)查看答案和解析>>
科目:高中化学 来源: 题型:
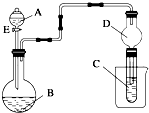 用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
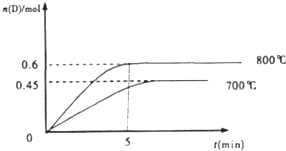
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com