
| A、1 mol氦气分子中含2NA个氦原子 |
| B、25℃时,l L pH=13的Ba(OH)2 溶液中含有OH-的数目为0.1NA |
| C、1.8 g重水(21H2O)中所含质子的个数为NA |
| D、1L 0.2mol/L的FeCl3溶液中Fe3+的数目为0.2NA |
| 1.8g |
| 20g/mol |


 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
| A、所有元素中原子半径最小的是F |
B、根据π键的成键特征判断C-C的键能与  键能的关系是双键的键能小于单键的键能的2倍 键能的关系是双键的键能小于单键的键能的2倍 |
| C、元素电负性越小,元素非金属性越强 |
| D、第n周期第n主族的元素均为金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显红色,它们相互转化关系如图所示.
A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显红色,它们相互转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| 正极 | 负极 | 电解质溶液 | |
| A | Zn | Cu | CuCl2 |
| B | Cu | Zn | H2SO4 |
| C | Cu | Zn | CuSO4 |
| D | Zn | Fe | CuCl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
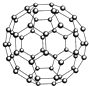
| A、28 g N60单质(见如图)中含有的N-N键键数为3NA |
| B、常温常压下,28 g C2H4和C3H6的混合气体中含有碳原子的数目为2NA |
| C、一定温度下,1 L0.5mol/L 的NH4Cl溶液与2 L 0.25 moL/L NH4Cl溶液含NH4+数目相等 |
| D、含有2NA个阴离子的CaC2在标准状况下,能产生约44.8L的乙炔气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
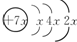 ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期除稀有气体外半径最大的元素,C的最外层有三个单电子,E的外围电子排布式为3d64s2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、控制含磷洗涤剂的生产和使用,防止水体富营养化,保护水资源 |
| B、研究采煤、采油新技术,大量开发新矿山,提高产量以满足工业生产的快速发展 |
| C、开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料 |
| D、实现资源的“3R”利用,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、提高资源的循环利用(Recycle),以此来推进生态文明建设 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| ①取5ml0.2mol?L-1的Fe(NO3)3溶液和5ml0.2mol?L-1的KI溶液,充分反应后加入5ml CCl4溶液,振荡静置,取上层溶液,分置于A、B两支试管中 | |
| ② ③ | 若溶液不变红色,则假设1成立,否则假设1不成立; 若溶液显紫色,则假设2成立,否则假设2不成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com