


科目:高中化学 来源: 题型:
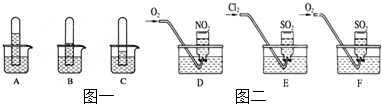
 某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如图所示的实验装置.请你根据他们的思路,完成下述的实验报告.
某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如图所示的实验装置.请你根据他们的思路,完成下述的实验报告.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Q1+Q2+Q3 |
| B、0.5(Q1+Q2+Q3) |
| C、0.5 Q1-1.5 Q2+0.5Q3 |
| D、1.5Q1-0.5Q2+0.5Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | H2 | CO | CH4 |
| 燃烧热kJ?mol-1 | 285.8 | 283.0 | 890.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HClO、浓硫酸、HNO3均具有氧化性,都是氧化性酸 |
| B、H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物 |
| C、HF、CH3COOH、CH3CH2OH都易溶于水,都是电解质 |
| D、HCOOH、H2CO3、H2SO4分子中均含有两个氢原子,都是二元酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A为中学化学中的一种深蓝色盐,B、C为日常生活中常见的金属单质,D、G为无色无味气体,各物质之间的转化关系如下图(电解采用惰性电极,部分反应产物已略去).请回答下列问题:
已知A为中学化学中的一种深蓝色盐,B、C为日常生活中常见的金属单质,D、G为无色无味气体,各物质之间的转化关系如下图(电解采用惰性电极,部分反应产物已略去).请回答下列问题:| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| H溶液的体积(mL) | 100 | 100 | 100 | 100 |
| 加入B、C合金的质量(g) | 3 | 6.6 | 9 | 12 |
| 剩余固体的质量(g) | 0 | 0.64 | 3.2 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、w=
| ||
B、w=
| ||
C、C=
| ||
D、b=
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com