
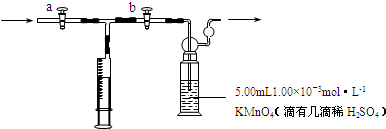
| 5×0.005L×1.00×10-3mol/L |
| 4 |
| 1.875×10-4×103mg |
| 50L |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、②③ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用活性炭去除冰箱中的异味 |
| B、用热碱水清除炊具上残留的油污 |
| C、用浸泡过高锰酸钾溶液的硅藻土保鲜水果 |
| D、用含硅胶、铁粉的透气小袋与食品一起密封包装 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:| 化学键 | C-H | Cl-Cl | C-Cl | H-Cl |
| 键能/kJ?mol-1 | X | 243 | 330 | 432 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如图所示的实验装置.请你根据他们的思路,完成下述的实验报告.
某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如图所示的实验装置.请你根据他们的思路,完成下述的实验报告.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molCl2参加的任何反应,反应过程中转移电子数都是2NA | ||
| B、常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA | ||
C、标准状况下,1L乙醇完全燃烧产生CO2分子的数目为
| ||
| D、将10mL质量分数为98%的浓H2SO4,用水稀释至100mL,H2SO4的质量分数大于9.8% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | H2 | CO | CH4 |
| 燃烧热kJ?mol-1 | 285.8 | 283.0 | 890.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com