
【题目】莽草酸的结构简式如图所示,下列关于莽草酸的说法正确的是( )
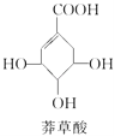
A.可用溴水鉴别莽草酸、乙醇、四氯化碳和苯
B.1mol莽草酸在催化剂条件下与2mol H2发生加成反应
C.分子中含有2种官能团
D.水溶液中羧基和羟基均能电离出H+
科目:高中化学 来源: 题型:
【题目】(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理__________,哪些违反了洪特规则__________。
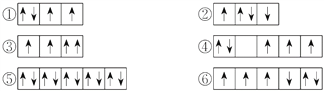
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为__________;其最高价氧化物对应水化物的化学式是__________。
(3)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列。
①2s ②3d ③4s ④3s ⑤4p ⑥3p
轨道能量由低到高排列顺序是__________。
【答案】 ③ ②④⑥ 1s22s22p63s23p4 H2SO4 ①④⑥③②⑤
【解析】试题分析:(1)在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋状态相反,称为泡利不相容原理;当电子排布在同一个能级的不同轨道时,基态原子中的电子总是单独优先占据一个轨道,而且自旋状态相同,称为洪特规则;(2)根据激发态原子核外电子排布式知该元素核外有16个电子,根据能量最低原理分析其基态原子核外电子排;(3)相同电子层上原子轨道能量的高低:ns<np<nd;形状相同的原子轨道能量的高低:1s<2s<3s<4s……。
解析:(1)在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋状态相反,称为泡利不相容原理,所以违反泡利不相容原理的有③;当电子排布在同一个能级的不同轨道时,基态原子中的电子总是单独优先占据一个轨道,而且自旋状态相同,称为洪特规则,所以违反洪特规则的有②④⑥;(2)根据激发态原子核外电子排布式知该元素核外有16个电子,为S元素;根据能量最低原理,其基态原子核外电子排是1s22s22p63s23p4;S元素最外层有6个电子,所以最高价是+6价,最高价氧化物对应水化物的化学式是H2SO4;(3)相同电子层上原子轨道能量的高低:ns<np<nd;形状相同的原子轨道能量的高低:1s<2s<3s<4s……,多电子原子的原子轨道按轨道能量由低到高顺序是①④⑥③②⑤。
【题型】综合题
【结束】
18
【题目】四种短周期元素A、B、C、D的性质或结构信息如下。
信息①:原子半径大小:A>B>C>D
信息②:四种元素之间形成的某三种分子的比例模型及部分性质:
|
|
|
是地球上最常见的物质之一,常温为液态,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分 | 无色,无味且易燃,是21世纪的主要能源 | 弱酸,有强氧化性,可以用于消毒杀菌 |
请根据上述信息回答下列问题。
(1)甲、乙、丙中含有的共同元素是 (填名称)。
(2)B元素在周期表中的位置为 。
(3)上述元素的原子M层有一个未成对p电子的是 (填元素符号)。
(4)丙的电子式为 ,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200mL FeBr2溶液中逐渐通入C12,其中n(Fe3+)、n(Br2)随通入n(Cl2)的变化如图所示,下列说法不正确的是( )

A.氧化性强弱:Br2>Fe3+
B.由图可知,该FeBr2溶液的浓度为1molL─1
C.n(Cl2)= 0.12 mol时,溶液中的离子浓度有c(Fe3+):c(Br-)=1:8
D.c(FeBr2):c(Br2)= 1: 1时,反应的离子方程式:2Fe3++2Br-+2Cl2=2Fe3++Br2+4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于某有机物![]() 的性质叙述正确的是( )
的性质叙述正确的是( )
A. 1 mol该有机物可以与3 mol Na发生反应
B. 1 mol该有机物可以与3 mol NaOH发生反应
C. 1 mol该有机物可以与6 mol H2发生加成反应
D. 1 mol该有机物分别与足量Na或NaHCO3反应,产生的气体在相同条件下体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.标准状况下,22.4L苯所含有的分子数为NA
B.1mol羟基中含有的电子数为10NA
C.14g C2H4和C3H6混合气体含有的原子数为3NA
D.1L0.1mol/L的醋酸溶液中含有H+个数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性 ![]() >H2CO3>
>H2CO3>![]() >HCO3- ,综合考虑反应物的转化率和原料成本等因素,将
>HCO3- ,综合考虑反应物的转化率和原料成本等因素,将 转变
转变![]() 的方法有( )
的方法有( )
A.与稀 H2SO4 共热后,加入足量的 NaHCO3 溶液
B.与稀 H2SO4 共热后,加入足量的 Na2CO3 溶液
C.与足量的 NaOH 溶液共热后,再加入适量 H2SO4
D.与足量的 NaOH 溶液共热后,再通入足量 CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为与水相关的部分转化关系(水作反应物或生成物,部分产物和反应条件未列出).下列说法错误的是( )
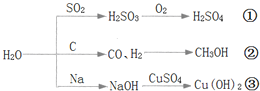
A.图中所示的反应均为氧化还原反应
B.途径![]() 是硫酸型酸雨的形成的重要途径
是硫酸型酸雨的形成的重要途径
C.工业上可用途径![]() 先制取水煤气,再合成甲醇等有机物
先制取水煤气,再合成甲醇等有机物
D.把金属钠投入到硫酸铜溶液中,发生途径![]() 反应,反应不生成铜单质
反应,反应不生成铜单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁是海水中含量较多的金属,镁合金及其镁的化合物用途非常广泛。
(1)Mg2Ni是一种储氢合金,已知:
Mg(s)+H2(g)=MgH2(S) △H1=- 74.5kJ·mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2=- 64.4kJ·mol-l
则:Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s)的△H3=__________.
(2)某科研小组用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁工艺的关键流程如下:

科研小组将MgCl2·6H2O在氩气气氛中进行热重分析,结果如下图(TG表示残留固体质量占原样品总质量的百分数)。
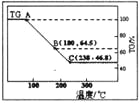
①图中AB线段为“一段脱水”,试确定B点对应固体物质的化学式_________________;图中BC线段为“二段脱水”,在实验中通入H2和Cl2燃烧产物的目的是_______________。
②该工艺中,可以循环使用的物质有_____________。
(3)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是________________,该化合物水解时生成甲烷、氯化镁和氢氧化镁,请写出该反应的化学方程式__________________。
(4)储氢材料Mg(AIH4)2在110~200℃的反应为:Mg(AIH4)2=MgH2+2Al+3H2↑;每转移3 mol电子生成Al的质量为_______________。
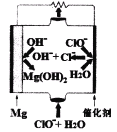
(5)“镁一次氯酸盐”燃料电池的装置如右图所示,该电池的正极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) ΔH=57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g) ΔH=57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
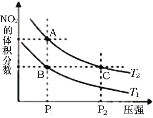
A.由状态B到状态A,可以用加热的方法
B.A、C两点气体的颜色:A深,C浅
C.A、C两点的反应速率:A>C
D.A、C两点气体的平均相对分子质量:A>C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com