
【题目】羟甲香豆素是一种治疗胆结石的药物,合成路线如下图所示:

已知:
(1)A属于芳香烃,其分子式是________.B中所含的官能团是________.
(2)C→D的反应类型是________.
(3)E属于脂类.仅以乙醇为有机原料,选用必要的无机试剂合成E,写出有关化学方程式: ____________________________.
(4)已知:2E![]() F+C2H5OH.F的结构简式为________.
F+C2H5OH.F的结构简式为________.
【答案】 C6H6 硝基 取代反应 2CH3CH2OH+O2![]() 2CH3CHO+2H2O、2CH3CHO+ O2→2CH3COOH、CH3COOH+CH3CH2OH
2CH3CHO+2H2O、2CH3CHO+ O2→2CH3COOH、CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O CH3CH2OOCCH2COCH3
CH3COOCH2CH3+H2O CH3CH2OOCCH2COCH3
【解析】由羟甲香豆素的结构简式并结合D的分子式可知D为
则C为![]() ,B为
,B为 ,因A是芳香烃,A与浓硝酸在浓硫酸作用下发生硝化反应生成B,则A为
,因A是芳香烃,A与浓硝酸在浓硫酸作用下发生硝化反应生成B,则A为![]() ,再由题中已知信息方程式可知,E为CH3COOCH2CH3,F为CH3CH2OOCCH2COCH3。
,再由题中已知信息方程式可知,E为CH3COOCH2CH3,F为CH3CH2OOCCH2COCH3。
(1)、由以上分析可知,A为苯,则其分子式是C6H6,B为 ,则B中所含的官能团是硝基;
,则B中所含的官能团是硝基;
(2)、C为![]() ,与水在硫酸并加热的情况下发生取代反应生成
,与水在硫酸并加热的情况下发生取代反应生成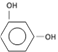 ,故答案为:取代反应;
,故答案为:取代反应;
(3)、E为CH3COOCH2CH3,可由乙醇先氧化制取乙醛,再由乙醛氧化制取乙酸,再利用乙酸和乙醇发生酯化反应生成乙酸乙酯,所以各个反应的化学方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O、2CH3CHO+ O2→2CH3COOH、CH3COOH+CH3CH2OH
2CH3CHO+2H2O、2CH3CHO+ O2→2CH3COOH、CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(4)、根据D+F→羟甲香豆素+乙醇,因D为 ,结合
,结合![]() ,并结合E为乙酸乙酯,得F为CH3CH2OOCCH2COCH3。
,并结合E为乙酸乙酯,得F为CH3CH2OOCCH2COCH3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:

回答下列问题:
(1)步骤①所得废渣的成分是_____________(写化学式),操作II的名称是________________。
(2)步骤②、③的变化过程表示为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n(水层)+2nHA(有机层)![]() 2RAn(有机层)+nH2SO4(水层)
2RAn(有机层)+nH2SO4(水层)
③中X试剂为_____________(写化学式)。
(3)按要求完成下列方程式
④的离子方程式为_________________________________________。
加氨水调节pH过程中涉及的离子方程式为: _________________、_______________。
(4)25时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
在实际生产中,⑤中加入氨水,调节溶液的最佳pH为________;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<_________mol/L(已知:25时,Ksp[Fe(OH)3]=2.610-39)。
(5)该工艺流程中,可以循环利用的物质有___________和_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(多选)在标准状况下,m g气体A与n g气体B的分子数相同,下列说法中不正确的是( )
A.两种气体A与B的相对分子质量之比为m:n
B.同质量气体A与B的分子数之比为m:n
C.同温同压下,A,B两气体的密度之比为n:m
D.相同状况下,同体积A,B两气体的质量之比为m:n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)某常见气体在标准状况下的密度为1.25gL﹣1 , 该气体的摩尔质量为 .
(2)在一密闭容器中充入a mol NO和b mol O2 , 可发生如下反应:2NO+O2=2NO2 , 充分反应后容器中氮原子和氧原子的个数之比为 .
(3)同温同压相同体积的CO2和O2 , 其原子数目之比为 , 密度之比为 .
(4)在标准状况下,CO和CO2的混合气体共39.2L,质量为61g.则两种气体的物质的量之和为mol,其中CO2为mol,CO的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,l mol X和n mol Y在体积为2L的密闭容器中发生如下反应:X(g) + Y(g)![]() 2Z(g) + M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是
2Z(g) + M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是
A. 用X表示5min内此反应的反应速率是(0.1—0.2a)mol·(L·min)—1
B. 当混合气体的质量不再发生变化时,说明反应达到平衡状态
C. 向平衡后的体系中加入l mol M,平衡向逆反应方向移动
D. 向上述平衡体系中再充入l mol X,v(正)增大,v(逆)减小,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将某铝硅合金分成质量相等的两份,分别与足量的盐酸和NaOH溶液充分反应,放出H2的体积(在相同温度和压强下)的关系正确的是
A. 一样多 B. 前者多 C. 后者多 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积为2 L的密闭容器中充人2 mol A气体和1 mol B气体,在一定条件下发生如下反应:2A(g)+B(g) ![]() 3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
①用物质A表示该反应的平均反应速率为0.2 mol·L-1·s-1
②用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
A. ①②③ B. ①③ C. ②④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用软锰矿(主要为MnO2,含杂质Al2O3和闪锌矿(主要为ZnS,含杂质FeS) 共同生产干电池的原料Zn和MnO2,同时获得一些副产品,工艺流程如下:

已知:硫酸浸取液的主要成分为ZnSO4、MnSO4、Fe2(SO4)3、Al2(SO4)3
(1)“浸取”时发生的反应中,还原产物为_______________ (填化学式)。
(2)①“净化除杂”时,加入的物质X可能为______________(填选项字母)。
A.MnCO3 B. Zn2(OH)2CO3 C.NaOH D. KOH
②相关离子开始沉淀和完全沉淀的pH如下表所示,加入X后,溶液pH应调整到________。
离子 | 开始沉淀pH | 完全沉淀pH |
Fe3+ | 2.3 | 3.2 |
A13+ | 4.2 | 5.4 |
Zn2+ | 7.2 | 8.0 |
Mn2+ | 8.3 | 9.8 |
(3)只用一种试剂,即可从 “灼烧”所得的Fe2O3和Al2O3混合物中分离得到Fe2O3。该反应
的离子方程式为____________________________________。
(4)“电解”时,发生反应的化学方程式为____________________________________。
(5)从Na2SO4溶液中得到芒硝晶体(Na2SO4 10H2O),需要进行的实验操作有______、_____、过滤、洗涤、干燥等.
(6)Zn和MnO2的传统生产工艺主要经历矿石焙烧、硫酸浸出、电解等过程,与传统工艺相比,该工艺流程的优点为________________________________。
(7)用生产的Zn和MnO2制成干电池,在碱性条件下工作时有MnOOH生成,则该电池正极的电极反应式为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com