
����Ŀ����ҵ����ƽ�VOSO4�е�K2SO4��SiO2���ʳ�ȥ�����յõ�V2O5���������£�

�ش��������⣺
��1����������÷����ijɷ���_____________��д��ѧʽ��������II��������________________��
��2������ڡ��۵ı仯���̱�ʾΪ����ʽR��ʾVO2+��HA��ʾ�л���ȡ������R2(SO4)n(ˮ��)+2nHA(�л���)![]() 2RAn(�л���)+nH2SO4(ˮ��)
2RAn(�л���)+nH2SO4(ˮ��)
����X�Լ�Ϊ_____________��д��ѧʽ����
��3����Ҫ��������з���ʽ
�ܵ����ӷ���ʽΪ_________________________________________��
�Ӱ�ˮ����pH�������漰�����ӷ���ʽΪ�� _________________��_______________��
��4��25ʱ��ȡ����������������õ��������ʺ���ҺpH֮���ϵ���±���
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
��������% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
��ʵ�������У����м��백ˮ��������Һ�����pHΪ________������������Ϊ93.1%ʱ������Fe(OH)3����������Һ��c(Fe3+)<_________mol/L����֪��25ʱ��Ksp[Fe(OH)3]=2.610-39����
��5���ù��������У�����ѭ�����õ�������___________��_____________��
���𰸡� SiO2 ��ȡ����Һ H2SO4 6VO2++ClO3-+9H2O=6VO3-+Cl-+18H+ NH3��H2O+H+=NH4++H2O NH4++VO3-=NH4VO3�� 1.7~1.8����1.7��1.8����һ���� 2.61��0-3mol/L ��������ˮ��NH3��NH3��H2O �л���ȡ����HA���л��ܼ�����ȡ����л�����
����������VOSO4�е�K2SO4��SiO2���ʳ�ȥ�����յõ�V2O5�����̣�ˮ�ܹ��˵õ���VO2+��SO42-��K+����Һ�������л���ȡ����Һ�õ���VO2+���л��㣬�پ�������ȡ�õ�ˮ�㣬����KClO3����VO2+ΪVO3-�����백ˮ������ҺPH�γ�NH4VO3���������յõ�V2O5��
(1)�Ϸ�����(��Ҫ�ɷ�V2O5��Fe2O3��SiO2��)���ܺ�V2O5��Fe2O3���ᷴӦ���������費���ᷴӦ�����˵õ�����Ϊ�������裬��������ͼ������II�Ǽ����л���ȡ��������ȡ�ͷ�Һ���ʴ�Ϊ��SiO2����ȡ����Һ��
(2)���з���ȡʱ�����X�Լ�������ƽ��������У����Լ�����������ƽ��������У��ʴ�Ϊ��H2SO4��
(3)�ܵķ�ӦΪ���������VO2+����VO3-�����ݵ���غ��ԭ���غ���ƽ�õ��ܵ����ӷ���ʽΪ��6VO2++ClO3-+9H2O=6VO3-+Cl-+18H+���Ӱ�ˮ����pH����ˮ���ᷢ���кͷ�Ӧ����Ӧ��������NH4VO3��������Ӧ�����ӷ���ʽΪNH3��H2O+H+=NH4++H2O��NH4++VO3-=NH4VO3�����ʴ�Ϊ��6VO2++ClO3-+9H2O=6VO3-+Cl-+18H+��NH3��H2O+H+=NH4++H2O��NH4++VO3-=NH4VO3����
(4)���ݱ��������жϣ����м��백ˮ��������ҺpH���ֵΪ1.7-1.8����ʱ�������ʴﵽ�����Ҫ��ˮ����С������������Ϊ93.1%ʱ������Fe(OH)3��������ʱpH=2��c(H+)=10-2mol/L��c(OH-)=10-12mol/L������Һ��c(Fe3+)Ũ�������ܶȻ����㣬Ksp[Fe(OH)3]=c(Fe3+)��c3(OH-)=2.6��10-39������õ�c(Fe3+)=2.6��10-3molL-1��������Fe(OH)3����������Һ��c(Fe3+)��2.6��10-3molL-1���ʴ�Ϊ��1.7-1.8��2.6��10-3molL-1��
(5)��������ͼ�����ʲμӷ�Ӧ����Ӧ�����������ɵ����ʣ����ظ����õ����ʿ���ѭ�����ã��������л���ȡ������������ѭ�����ã��ʴ�Ϊ��������ˮ���л���ȡ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����14�֣�������ؿ�������������������ѧ��ѧ����������������ҵ�ϣ������̿��Ƹ�����ص��������£�

��ش��������⣺
��1������������Ҫ������CO2���壮д��ʵ������ȡCO2�Ļ�ѧ����ʽ������������ ��
��2��KMnO4ϡ��Һ��һ�ֳ��õ���������������ԭ��������������ͬ������������������ĸ����
a��75%�ƾ� b��˫��ˮ c������ d�� 84����Һ��NaClO��Һ��
��3��д���������̺�����������������ͨ�����ʱ��������Ҫ��ѧ��Ӧ�ķ���ʽ�� ��
��4�����������п���ѭ��ʹ�õ������������������� �������������� ��д��ѧʽ����
��5���ⶨ���������Ʒ���Ȳ��������̵ζ�������������Һ�еμ���������Һ��������ɫ����������Һ���Ϻ�ɫ�պ���ɫ�Ұ���Ӳ��ָ��������ﵽ�ζ��յ㡣д���÷�Ӧ�����ӷ���ʽ�� ��
��6����֪�������£�Ksp[Mn��OH��2]=2.4��10-13����ҵ�ϣ�����pH���Գ�����ˮ��Mn2+����pH=10ʱ����Һ��c��Mn2+��= ___________________��
��7���������������������������� ������������KMnO4��K2CO3���������ܽ����ϵIJ��죬��������������������������裩�����ȹ��˵õ�KMnO4�־��壮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£������й�������ȷ����
A. 0.1mol/L ��ˮ��c(H+)/c(OH-)=1��10-8����c(H+)=1��10-3mol/L
B. pH=7��NH4Cl��NH3��H2O�Ļ����Һ��c(Cl-)>c(NH4+)>c(H+)=c(OH-)
C. ��0.1mol/L (NH4)2C2O4��Һ�У�c(NH4+)=2[c(C2O42-)+c(HC2O4-)+c(H2C2O4)]
D. Ũ�Ⱦ�Ϊ0.1mol/L�����������Һ������������Һ�������ϣ�c(SO42-)=c(Na+) >c(NH4+) >c(H+) >c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ò�ͬ�ķ�������ɽ������������Ϊ��ͬ��������磬��ij�����彲P2O5��SO2��SO3��CO2��Cl2O7�ȹ�Ϊһ�࣬������������������ͬ��һ������� ��
A. CO B. NO C. N2O5 D. NO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��a��b��ʯī�缫��ͨ��һ��ʱ���a��������Һ�Ժ�ɫ������˵����ȷ����(����)

A. Pt������64 g Cu����ʱ��b������22.4 L����
B. a���ĵ缫��Ӧ��2Cl����2e��= Cl2��
C. ��������CuSO4��Һ��pH������
D. X���ǵ�Դ������Y���ǵ�Դ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�����������ǣ� ��
A. ��ҩ��ȡ������Na2SO4 ����
B. ����ʢ��2/3���K2SO4��Һ���Թ�
C. �ý�ͷ�ιܵμ�����NaCl��Һ
D. ��10mL��Ͳ��ȡ8mL 1.0mol/LNaOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ͼ�����Ӧ���ǣ� ����

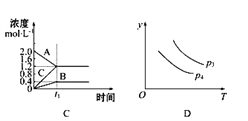
A. ͼA��N2(g)+3H2(g)![]() 2NH3(g)�Ļ�ѧƽ��ͼ����t0ʱ�̳���һ������NH3��ƽ�������ƶ�
2NH3(g)�Ļ�ѧƽ��ͼ����t0ʱ�̳���һ������NH3��ƽ�������ƶ�
B. ͼB�У�p2>p1��T1>T2
C. ͼC��ʾ�Ļ�ѧ����ʽΪ2A�TB+3C
D. ͼD��Ӧ��Ӧ2X(g)+3Y(g)![]() 2Z(g) ��H<0��y���Ա�ʾY�İٷֺ���
2Z(g) ��H<0��y���Ա�ʾY�İٷֺ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ǽ��㶹����һ�����Ƶ���ʯ��ҩ��ϳ�·������ͼ��ʾ��

��֪��
��1��A���ڷ������������ʽ��________��B�������Ĺ�������________��
��2��C��D�ķ�Ӧ������________��
��3��E����֬�࣮�����Ҵ�Ϊ�л�ԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�E��д���йػ�ѧ����ʽ�� ____________________________��
��4����֪��2E![]() F+C2H5OH��F�Ľṹ��ʽΪ________��
F+C2H5OH��F�Ľṹ��ʽΪ________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com