
����Ŀ��Ϊ̽���������ܽ��ԣ�ij��ȤС�鰴��ͼ��ʾװ�ý���ʵ��(fΪֹˮ��)����ش��������⣺

��1��д��ʵ������ȡ�����Ļ�ѧ����ʽ____________________��
��2��Ҫ�õ�����İ�����ѡ��________������ĸ�����������
A����ʯ�� B��Ũ���� C��Ũ���� D������������Һ
��3������ͼװ�ý�����Ȫʵ�飬��ƿ����װ�����ﰱ��(��״��)������ˮ������IJ�����__________��ʵ���ԭ����_____________��
��4�����״���£�����ʵ�����ƿ�����ʵ����ʵ���Ũ����________mol��L��1��
���𰸡� 2NH4Cl��Ca(OH)2![]() CaCl2��2NH3����2H2O A ��ֹˮ��f��������ͷ�ι��е�Һ�壬������ҡ�� ��ƿ������������ˮ����ʹ��ƿ������ѹǿѸ�ټ�С
CaCl2��2NH3����2H2O A ��ֹˮ��f��������ͷ�ι��е�Һ�壬������ҡ�� ��ƿ������������ˮ����ʹ��ƿ������ѹǿѸ�ټ�С ![]()
����������1���ڼ��������£��Ȼ�狀��������Ʒ�Ӧ�����Ȼ��ơ�ˮ�Ͱ�������Ӧ����ʽ��2NH4Cl��Ca(OH)2![]() CaCl2��2NH3����2H2O
CaCl2��2NH3����2H2O
�ʴ�Ϊ��2NH4Cl��Ca(OH)2![]() CaCl2��2NH3����2H2O��
CaCl2��2NH3����2H2O��
��2��Ũ�����Ũ����������ԣ������Ǽ������壬���ԣ�Ũ�����Ũ���ᶼ���ܸ��ﰱ����������������ˮ����������������Һ���ܸ������壬�ʴ�Ϊ��A��
��3��������һ�ּ�������ˮ�����壬����ͷ�ι��е�ˮ������ƿ�У�ƿ��ѹǿ��С���������ѹ�������£�ˮ��ѹ��ƿ�ڣ��γ���Ȫ���ʴ�Ϊ����ֹˮ��f��������ͷ�ι��е�Һ�壬������ҡ����ƿ����ֹˮ�С�
��4������ƿ�����ΪVL,���״���£����ʵ���ΪVL/22.4L.mol-1����ʵ�����ƿ�����ʵ����ʵ���Ũ����1/22.4mol��L��1,�𰸣�1/22.4��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ����٤��������ֵ������˵����ȷ���ǣ� ��
A.n��H2CO3����c��HCO3����֮��Ϊ1mol��NaHCO3��Һ�У�����Na+��ĿΪNA
B.5g 21H��31H�Ļ������Ⱥ˾۱䷴Ӧ��21H+31H��42He+10n�������������ӣ�10n����ΪNA
C.1L 0.1mol/L�Ҵ���Һ�д��ڵĹ��ۼ�����Ϊ0.8NA
D.56g ��������������Ӧ���������õ�3NA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���a mol/L��ˮ����μ������ᣬ������������ȷ���ǣ� ��
A.pH��С
B.![]() ����
����
C.ˮ�ĵ���̶Ȼ������
D.Kw����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������н��з�Ӧ��X��g��+2Y��g��2Z��g����H��0����ͼ����ȷ��ʾ�÷�Ӧ�й��������仯���ɵ��ǣ� ��
A.
B.
C.
D.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʳ�����л��в���ˮ��������з��������ķ�����
A. ���� B. ���� C. ���� D. ��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����BaCl2��Һ��ͨ��SO2����Һ��������֧�Թ��У���һ���м���NaOH��Һ�����ְ�ɫ����A����һ��ͨ������Cl2��������ɫ����B���Իش��������⣺
��1����������SO2��ˮ�ķ�Ӧ��BaCl2��Һ��ͨ��SO2������������������������������������Ӧ����Ҳ����������Ӧ�������������˴�ӦΪ ��ԭ���� ��
��2������A�Ļ�ѧʽΪ ���ó����ܷ�����ϡ��� _��
��3��д�����ɳ���B�����ӷ���ʽ�� ��
��4������2.33 g����B�������ı�״���µ�Cl2 mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijϡ�����ϡ����Ļ����Һ200 mL��ƽ���ֳ����ݡ�������һ�������� ͭ�ۣ��������19.2 g(��֪����ֻ����ԭΪNO����)������һ���������� �ۣ�������������������������ӵı仯����ͼ��ʾ�����з�����������ȷ����(����)

A. ͼ�У�AB�εķ�ӦΪFe��2Fe3��===3Fe2������Һ����������Ϊ��������
B. ԭ��Һ������Ũ��Ϊ2.5 mol��L��1
C. ԭ�����Һ����������ӵ����ʵ���Ϊ0.4 mol
D. ͼ�У�OA�β�����������һ��������BC�β���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������仯�����ת������Դ���úͻ�����������Ҫ�о����⣮
��1����֪��ӦI��2SO2��g��+O2��g��2SO3��g������H=��196.6KJmol��1��ӦII��2NO��g��+O2��g��2NO2��g������H=��113.0KJmol��1
��SO2��g����NO2��g����Ӧ����SO3��g����NO��g�����ȷ�Ӧ����ʽΪ ��
��2�������ھ��Ⱥ����ܱ�������ͨ��һ������SO2��O2 �� һ�������·�����ӦI��һ��ʱ���ڣ�����Ӧ������ʱ��仯������ͼ��ʾ������a��ʱ����Ӧ����ﵽ����δ�ﵽ����ƽ��״̬��t1��t3ʱ���ڣ�v����������С����Ҫԭ���� �� ������������ͬ���Ⱥ����ܱ������зֱ����A��2molSO2��g����1molO2��g����B��2molSO3��g��������������ͬ��������ӦI���ﵽƽ��ʱ����÷�Ӧ��ƽ�ⳣ����AB�����������=��������������
��3����֪�����£�H2S�ĵ��볣����K1=1.3��10��7 �� K2=7.1��10��15 �� Ksp��H2S��=4��10��53 �� Ksp��Ag2S��=6.3��10��50 �� Ksp��HgS��=1.6��10��52 �� ��0.1mol/L H2S��Һ��pHԼΪ��ȡ��������ֵ������Ũ�Ⱦ�Ϊ0.001moll��1��AgNO3��Hg��NO3��2�����Һ��ͨ��H2S���壬��ʼ���ɳ�����c��S2����Ϊ ��
��4��NH3����ԭ�����\����SCR����ĿǰӦ�ù㷺���������������ѳ�����������NO��NO2�Ļ����6L������ͬ��ͬѹ��7L��NH3ǡ��ʹ����ȫת��ΪN2 �� ��ԭ���������NO��NO2�����ʵ���֮��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����a��ʾ���ȷ�Ӧ 2X��g��+Y��g��2Z��g�� ���й�����X��ת������ʱ��仯�Ĺ�ϵ����Ҫ�ı���ʼ������ʹ��Ӧ���̰�b���߽��У��ɲ�ȡ�Ĵ�ʩ�ǣ� �� 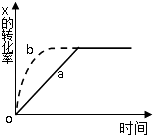
A.�Ӵ���
B.�Ӵ�X��Ͷ����
C.�����¶�
D.�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com