
| 1 |
| 2 |
| 1 |
| 2 |


 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
| A、苯的密度比水大 |
| B、能用酸性高锰酸钾溶液鉴别苯和甲苯 |
| C、苯环上存在碳碳单键和碳碳双键交替出现的结构 |
| D、苯能发生取代反应但不能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
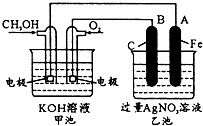 如图是一个化学过程的示意图.已知甲池的总反应式为:
如图是一个化学过程的示意图.已知甲池的总反应式为:| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Q2=Q1 | ||
| B、2Q2<Q1 | ||
| C、Q2<Q1=197kJ | ||
D、Q2=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某温度下,1LpH=8的纯水中含OH-为10-8NA |
| B、14g分子通式为CnH2n的链烃中含有的C=C键数目为NA |
| C、标准状况下,22.4LCl2与足量Fe反应,转移的电子数为3NA |
| D、常温下,1L0.1mol?L-1CH3COONa溶液中含有的Na+和CH3COO-总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用惰性电极电解饱和氯化钠溶液:2Cl-+2H+
| ||||
B、氯气通入浓氢氧化钠溶液中加热:3Cl2+6OH-
| ||||
| C、用稀硝酸溶解FeS固体:FeS+2H+═Fe2++H2S↑ | ||||
| D、硫酸氢钠溶液与足量氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

| B2H6 |
| H2O2/OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH水溶液 |
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com