
| A、溴单质有强氧化性,有毒,所以可用于生产熏蒸剂,杀毒剂 |
| B、液溴应保存在磨口玻璃塞棕色细口试剂瓶中,并加少量水进行水封 |
| C、碘易溶于酒精,所以能用酒精从碘水中将碘萃取出来 |
| D、用加热的方法可将碘中混有的少量沙子除去 |


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
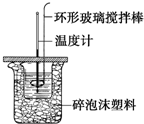 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:| (m酸+m碱)?c?(t终-t始) |
| n |
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 盐酸溶液 | 氢氧化钠溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
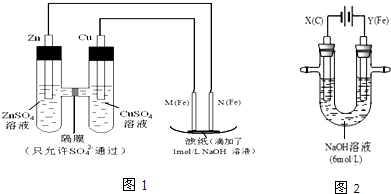
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④③ | B、④③②① |
| C、①④②③ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
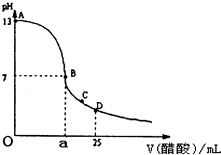 如图为向25mL0.1mol?L-NaOH溶液中逐滴加入0.2mol?L-醋酸溶液过程中溶液pH的变化曲线,请回答:
如图为向25mL0.1mol?L-NaOH溶液中逐滴加入0.2mol?L-醋酸溶液过程中溶液pH的变化曲线,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KAlSi3O6 |
| B、KAlSi3O8 |
| C、K2AlSi3O10 |
| D、KAl2Si6O14 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com