
| 0.01mol/L×1L |
| 10L |
| 10-14 |
| 10-3 |


科目:高中化学 来源: 题型:
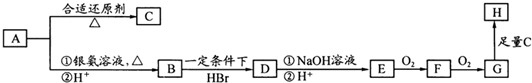
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴单质有强氧化性,有毒,所以可用于生产熏蒸剂,杀毒剂 |
| B、液溴应保存在磨口玻璃塞棕色细口试剂瓶中,并加少量水进行水封 |
| C、碘易溶于酒精,所以能用酒精从碘水中将碘萃取出来 |
| D、用加热的方法可将碘中混有的少量沙子除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3-的电离程度大于HCO3-的水解程度 |
| B、c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| C、c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| D、存在的电离有:NaHCO3=Na++HCO3-,HCO3-?H++CO32-,H2O?H++OH-,HCO3-+H2O?H2CO3+OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
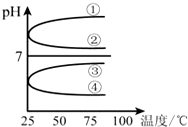 (1)稀释0.1mol?L-1氨水时,随着水量的增加而减小的是
(1)稀释0.1mol?L-1氨水时,随着水量的增加而减小的是| c(NH3?H2O) |
| c(OH-) |
| c(OH-) |
| c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.4g金属镁与足量盐酸完全反应,失电子总数为0.2NA |
| B、2NA个二氧化碳分子的质量为44g |
| C、0.1mol/L NaCl溶液中,Na+与Cl-离子总数为0.2NA |
| D、17g氨气中所含原子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com