
 (1)稀释0.1mol?L-1氨水时,随着水量的增加而减小的是
(1)稀释0.1mol?L-1氨水时,随着水量的增加而减小的是| c(NH3?H2O) |
| c(OH-) |
| c(OH-) |
| c(H+) |
 OH-+NH4+可知,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,加水促进电离,则n(NH3.H2O)减少;
OH-+NH4+可知,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,加水促进电离,则n(NH3.H2O)减少;| c(OH-).c(NH4+) |
| c(NH3.H2O) |
 OH-+NH4+可知,加水促进电离,则c(NH3.H2O)减少,c(OH-)减小,平衡正向移动,所以NH3.H2O分子减小的程度大,
OH-+NH4+可知,加水促进电离,则c(NH3.H2O)减少,c(OH-)减小,平衡正向移动,所以NH3.H2O分子减小的程度大,| c(NH3?H2O) |
| c(OH-) |
 OH-+NH4+可知,加水促进电离,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,c(H+)和c(OH-)的乘积不变,则c(H+)增大,所以
OH-+NH4+可知,加水促进电离,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,c(H+)和c(OH-)的乘积不变,则c(H+)增大,所以| c(OH-) |
| c(H+) |
 OH-+NH4+可知,加水促进电离,OH-的物质的量增大,故错误;
OH-+NH4+可知,加水促进电离,OH-的物质的量增大,故错误;| c(OH-).c(NH4+) |
| c(NH3.H2O) |
| 10-7×5×10-3 |
| 0.5a-5×10-3 |
| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |


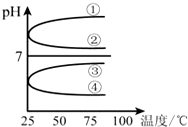
科目:高中化学 来源: 题型:
查看答案和解析>>
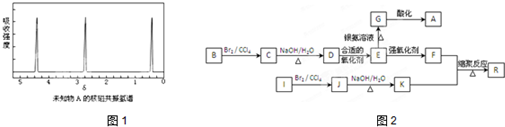
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
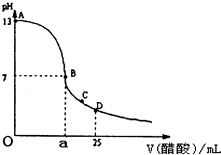 如图为向25mL0.1mol?L-NaOH溶液中逐滴加入0.2mol?L-醋酸溶液过程中溶液pH的变化曲线,请回答:
如图为向25mL0.1mol?L-NaOH溶液中逐滴加入0.2mol?L-醋酸溶液过程中溶液pH的变化曲线,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
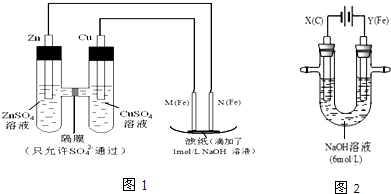
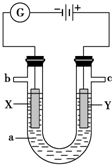 如图表示一个电解池,装有电解液a;X、Y是两块电极板通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
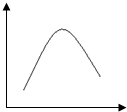 对如图的解读不正确的是( )
对如图的解读不正确的是( )| 选项 | 研究对象 | 横坐标 | 纵坐标 |
| A | 浓醋酸溶于水 | 加入水的量 | 导电能力 |
| B | A(g)?2B(g) | 压强 | 正反应速率 |
| C | 镁和稀盐酸反应 | 时间 | 反应速率 |
| D | 往密闭容器中通入 N2和H2发生反应: N2(g)+3H2(g)?2NH3(g)△H<0 | 温度 | NH3的体积分数 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0? | B、-2 | C、+1 | D、+2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、-CH3 |
| B、-CHO |
| C、-COOH |
| D、-OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com