
| A、0? | B、-2 | C、+1 | D、+2 |


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO32- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
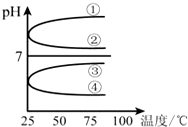 (1)稀释0.1mol?L-1氨水时,随着水量的增加而减小的是
(1)稀释0.1mol?L-1氨水时,随着水量的增加而减小的是| c(NH3?H2O) |
| c(OH-) |
| c(OH-) |
| c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、各平衡常数的大小与温度有关 |
| B、若温度升高则各平衡常数一定增大 |
| C、平衡常数的大小能说明反应(或电离、溶解)进行的程度 |
| D、平衡常数越大反应(或电离)程度越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(O2)=0.01 mol?L-1?s-1 |
| B、v(NH3)=0.02 mol?L-1?s-1 |
| C、v(H2O)=0.04 mol?L-1?s-1 |
| D、v(NO)=0.03 mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2能与水反应,所以Na2O2可以作气体的干燥剂 |
| B、溴化银具有感光性,碘化银不具有感光性,但AgI可用于人工降雨 |
| C、碘易溶于酒精,所以可用酒精从碘水中萃取碘单质 |
| D、钠很活泼,故钠应保存在石蜡或煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、浓HNO3是还原剂,NO2是还原产物 |
| B、氧化性:浓HNO3>Fe(NO3)2 |
| C、氧化剂与还原剂的物质的量之比为4:1 |
| D、若反应产生了0.1mol NO2,转移的电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com